
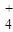 +OH-形成的平衡中,要使NH3?H2O的电离程度及c(OH-)都增大,可采取的措施是( )?
+OH-形成的平衡中,要使NH3?H2O的电离程度及c(OH-)都增大,可采取的措施是( )?

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
①F2和Br2的沸点 ②纯水在25 ℃和80 ℃时的pH ③同温下分别在100 g水中最多能溶解的无水CuSO4和CuSO4·5H2O的质量④25 ℃时,等体积的pH都等于3的盐酸和AlCl3溶液中,已电离的水分子数 ⑤在NH3+NO![]() N2+H2O反应中,被氧化和被还原的N原子数 ⑥耐火材料MgO和CaO的熔点 ⑦H-和H+半径 ⑧金刚石晶体和石墨晶体中,每个最小碳环里所含的实际碳原子数( )
N2+H2O反应中,被氧化和被还原的N原子数 ⑥耐火材料MgO和CaO的熔点 ⑦H-和H+半径 ⑧金刚石晶体和石墨晶体中,每个最小碳环里所含的实际碳原子数( )
A.①②⑥ B.①②③⑤ C.⑤⑥⑦ D.②⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
A.纯水在
B
C.在NH3+NO![]() N2+H2O的反应中,被还原和被氧化的N原子数
N2+H2O的反应中,被还原和被氧化的N原子数
D.H-和H+的离子半径
查看答案和解析>>
科目:高中化学 来源: 题型:
A
B.纯水在
C.在NH3+NO![]() N2+H2O反应中,被还原和被氧化的N原子数
N2+H2O反应中,被还原和被氧化的N原子数
D.pH相同的等体积的盐酸和醋酸分别与足量锌粒反应产生的气体体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com