
| A. | 1体积NO | B. | 1体积NO2和$\frac{1}{2}$体积O2 | ||
| C. | $\frac{1}{4}$体积O2 | D. | $\frac{1}{3}$体积NO |
分析 假定为3molNO2,通过饱和碳酸氢钠溶液,首先发生3NO2+H2O=2HNO3+NO,生成1molNO、2molHNO3,再发生反应:HNO3+NaHCO3=NaNO3+CO2↑+H2O,生成2molCO2,从饱和碳酸氢钠溶液出来的气体为1molNO、2molCO2及水蒸气,再通过浓硫酸干燥,出来的气体为1molNO、2molCO2,气体通过过氧化钠,发生反应2CO2+2Na2O2═2Na2CO3+O2、2NO+O2=2NO2,从过氧化钠出来的气体最终为0.5molO2、1molNO2,最后用排水法收集,发生反应4NO2+O2+2H2O=4HNO3,据此计算解答.
解答 解:假定为3molNO2,通过饱和碳酸氢钠溶液,首先发生3NO2+H2O=2HNO3+NO,生成1molNO、2molHNO3,再发生反应:HNO3+NaHCO3=NaNO3+CO2↑+H2O,生成2molCO2,从饱和碳酸氢钠溶液出来的气体为1molNO、2molCO2及水蒸气,再通过浓硫酸干燥,出来的气体为1molNO、2molCO2,气体通过过氧化钠,发生反应2CO2+2Na2O2═2Na2CO3+O2,生成1molO2,再发生反应2NO+O2=2NO2,1molNO消耗0.5molO2,生成1molNO2,故从过氧化钠出来的气体最终为0.5molO2、1molNO2,最后用排水法收集,发生反应4NO2+O2+2H2O=4HNO3,1molNO2消耗O2为1mol×$\frac{1}{4}$=0.25mol,故最终剩余的氧气为0.5mol-0.25mol=0.25mol,体积之比等于物质的量之比,故最终收集到的气体是0.25体积的O2,
故选C.
点评 本题考查混合物的有关计算,题目涉及的反应较多,计算量较大,需要学生细心计算,难度中等,清楚发生的反应是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①②③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
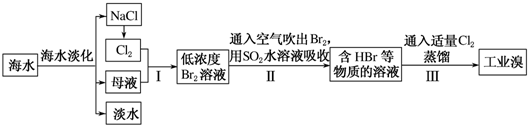
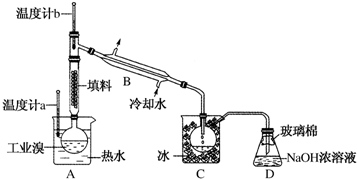
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.5% | B. | 25% | C. | <25% | D. | >25% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gC含有9NA个电子 | |
| B. | 标准状况下22.4LCCl4含有4NA个氯原子 | |
| C. | 标准状况下,33.6LN2和H2的混合气体中含3NA个原子 | |
| D. | 2.709×1024个原子的水分子含有1.5NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
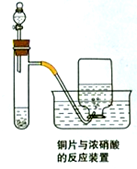 如图为铜片与浓硝酸反应的装置示意图,据图回答下列问题:
如图为铜片与浓硝酸反应的装置示意图,据图回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com