
| ²Ł×÷¹ż³Ģ | ŹµŃéĻÖĻó |
| ½«øÉŌļ“æ¾»µÄCO2»ŗ»ŗĶعż·ÅÓŠÄʵÄŅŃÅž”æÕĘųµÄøÉŌļ²£Į§¹ÜÖŠ£¬¼ÓČČ | ÄĘČ¼ÉÕ£¬»šŃęĪŖ»ĘÉ« |
| ·“Ó¦ŗóĄäČ“ | ¹Ü±Śø½ÓŠŗŚÉ«æÅĮ£ŗĶ°×É«ĪļÖŹ |
| ŹµŃé²½Öč | ŹµŃéĻÖĻó |
| ¢ŁÉŁĮæ°×É«ĪļÖŹÓŚŹŌ¹ÜÖŠ£¬¼ÓČėŹŹĮæĖ®£¬Õńµ“£¬ŃłĘ·Č«²æČÜÓŚĖ®£¬ĻņĘäÖŠ¼Ó¹żĮæµÄCaC12ČÜŅŗ³öĻÖ°×É«³Įµķ | ³öĻÖ°×É«³Įµķ |
| ¢Ś¾²ÖĆʬæĢ£¬Č”ÉĻ²ćĒåŅŗÓŚŹŌ¹ÜÖŠ£¬µĪ¼ÓĪŽÉ«·ÓĢŖŹŌŅŗ | ĪŽĆ÷ĻŌĻÖĻó |
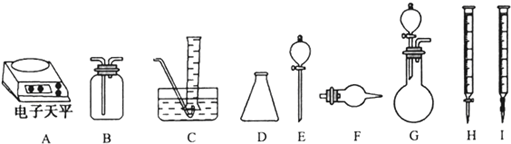
| ŹµŃé¹ż³ĢÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ | ŹµŃéĖłŠčŅĒĘ÷£ØÓĆ×ÖÄø±ķŹ¾£© | ŹµŃéĖłŠčŹŌ¼Į£ØÓĆ×Ö±ķŹ¾£© | ŹµŃéŠčÖ±½Ó²ā¶ØµÄÓŠ¹ŲĪļĄķĮæ£ØÓĆĪÄ×ÖĖµĆ÷£© |
·ÖĪö £Ø1£©°×É«¹ĢĢ廹æÉÄÜŹĒŃõ»ÆÄĘÓėĢ¼ĖįÄʵĻģŗĻĪļ£»
£Ø2£©¢ŁŃõ»ÆÄĘÄÜÓėĖ®·“Ӧɜ³ÉĒāŃõ»ÆÄĘ£¬ĒāŃõ»ÆÄĘ²»ÄÜÓėĀČ»ÆøĘ·“Ó¦£»
¢ŚŅĄ¾Ż·½°ø¢Ł¢ŚµÄ·“Ó¦ĻÖĻóŗĶ½įĀŪ£¬·ÖĪöŗĶĶʶĻÄĘŌŚ¶žŃõ»ÆĢ¼ÖŠČ¼ÉÕÉś³ÉĢ¼ĖįÄĘŗĶĢ¼£»
¢ŪŅĄ¾Ż·“Ó¦ĪļÖŠµÄŌŖĖŲŹŲŗć·ÖĪöÅŠ¶ĻÉś³ÉĪļµÄ×é³ÉŌŖĖŲ£»
£Ø3£©³ĘČ”Na2Oѳʷmg£Ø¼ŁÉčÖ»ŗ¬ÓŠNa2O2ŌÓÖŹ£©£¬Ķź³Éѳʷ֊Na2Oŗ¬ĮæµÄ²ā¶Ø£¬æÉŅŌ³ĘȔѳʷӌŅĒĘ÷DÖŠ£¬Ķعż¼ÓČėĖ®·“Ó¦ĶźČ«ŗ󣬲ā¶Ø·“Ó¦Ē°ŗó׶ŠĪĘæµÄÖŹĮæµĆµ½·Å³öŃõĘųÖŹĮ棬½įŗĻ»Æѧ·½³ĢŹ½¶ØĮæ¹ŲĻµ¼ĘĖć¹żŃõ»ÆÄĘÖŹĮæµĆµ½Ńõ»ÆÄĘÖŹĮæ·ÖŹż£»»ņŃ”ŌńGC×°ÖĆ£¬Ņ»¶ØÖŹĮæѳʷ֊µĪČėĖ®·“Ó¦ŗó²ā¶ØÉś³ÉŃõĘųµÄĢå»ż»»ĖćĪŖ±ź×¼×“æö¼ĘĖćµĆµ½ŃõĘųĮ棬ŅĄ¾Ż»Æѧ·½³ĢŹ½¶ØĮæ¹ŲĻµ¼ĘĖćµĆµ½¹żŃõ»ÆÄĘÖŹĮ棬µĆµ½Ńõ»ÆÄĘÖŹĮæ·ÖŹż£»»ņĄūÓƱź×¼ŃĪĖįČÜŅŗµĪ¶Ø·“Ó¦ŗóČÜŅŗÖŠÉś³ÉµÄĒāŃõ»ÆÄʵÄĮ棬½įŗĻŌŖĖŲŹŲŗćĮŠŹ½¼ĘĖćµĆµ½Ńõ»ÆÄĘŗĶ¹żŃõ»ÆÄʵÄÖŹĮ棬µĆµ½Ńõ»ÆÄĘÖŹĮæ·ÖŹż£»
£Ø4£©7.75gѳʷŌŚæÕĘųÖŠ³ä·Ö×ĘÉÕµĆµ½¹żŃõ»ÆÄĘ£¬ĄäČ“³ĘĮæ¹ĢĢåÖŹĮæ9.35g£¬½įŗĻ»Æѧ·½³ĢŹ½¶ØĮæ¹ŲĻµ¼ĘĖćŃõ»ÆÄĘÖŹĮæ·ÖŹż£»
½ā“š ½ā£ŗ£Ø1£©ÄĘŌŚ¶žŃõ»ÆĢ¼ÖŠČ¼ÉÕÕāŅ»»Æѧ·“Ó¦µÄ·“Ó¦ĪļÖŠÖ»ŗ¬ÓŠÄĘŌŖĖŲ”¢Ģ¼ŌŖĖŲŗĶŃõŌŖĖŲ£¬Ć»ÓŠĒāŌŖĖŲ£¬æÉÄÜÉś³ÉŃõ»ÆÄĘ»ņĢ¼ĖįÄĘ»ņ¶žÕߵĻģŗĻĪļ£¬
¹Ź“š°øĪŖ£ŗNa2OŗĶNa2CO3µÄ»ģŗĻĪļ£»
£Ø2£©¢ŁŃõ»ÆÄĘÄÜÓėĖ®·“Ӧɜ³ÉĒāŃõ»ÆÄĘ£¬ĒāŃõ»ÆÄĘ²»ÄÜÓėĀČ»ÆøĘČÜŅŗ·“Ó¦²śÉś°×É«³Įµķ£¬ĒŅĘäĖ®ČÜŅŗĻŌ¼īŠŌ£¬Ģ¼ĖįÄĘÄÜÓėĀČ»ÆøĘ·“Ӧɜ³ÉĀČ»ÆÄĘŗĶĢ¼ĖįøĘ°×É«³Įµķ£¬¹Ź¢ņ³ÉĮ¢£¬¹Ź“š°øĪŖ£ŗ¢ņ£»
¢ŚŅĄ¾ŻĻÖĻóŗĶŹµŃé·ÖĪöÅŠ¶ĻÄĘŌŚ¶žŃõ»ÆĢ¼ĘųĢåÖŠČ¼ÉÕÉś³ÉĢ¼ĖįÄĘŗĶĢ¼µ„ÖŹ£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ4Na+3CO2$\frac{\underline{\;µćČ¼\;}}{\;}$2Na2CO3+C£¬
¹Ź“š°øĪŖ£ŗ4Na+3CO2$\frac{\underline{\;µćČ¼\;}}{\;}$2Na2CO3+C£»
¢Ū±ūĶ¬Ń§ČĻĪŖ°×É«ĪļÖŹÓŠæÉÄÜŹĒĒāŃõ»ÆÄĘ£®ŹĒ“ķĪóµÄ£¬ŌŚ·“Ó¦¹ż³ĢÖŠ£¬ŹĒÄĘŌŚ¶žŃõ»ÆĢ¼ĘųĢåÖŠ µÄČ¼ÉÕ·“Ó¦£¬ĪŽĒāŌŖĖŲµÄ“ęŌŚ£¬ŹµŃéŅĄ¾ŻŌŖĖŲŹŲŗćæÉÖĆ»»²»æÉÄÜÉś³ÉĒāŃõ»ÆÄĘ£¬
¹Ź“š°øĪŖ£ŗ²»ÕżČ·£¬ŅņĪŖ·“Ó¦ĪļÖŠĪŽHŌŖĖŲ£Ø»ņĪ„±³ÖŹĮæŹŲŗć¶ØĀÉ£©£»
£Ø3£©³ĘČ”Na2Oѳʷmg£Ø¼ŁÉčÖ»ŗ¬ÓŠNa2O2ŌÓÖŹ£©£¬Ķź³Éѳʷ֊Na2Oŗ¬ĮæµÄ²ā¶Ø£¬æÉŅŌ³ĘȔѳʷӌŅĒĘ÷DÖŠ£¬Ķعż¼ÓČėĖ®·“Ó¦ĶźČ«ŗ󣬲ā¶Ø·“Ó¦Ē°ŗó׶ŠĪĘæµÄÖŹĮæµĆµ½·Å³öŃõĘųÖŹĮ棬½įŗĻ»Æѧ·½³ĢŹ½¶ØĮæ¹ŲĻµ¼ĘĖć¹żŃõ»ÆÄĘÖŹĮæµĆµ½Ńõ»ÆÄĘÖŹĮæ·ÖŹż£»»ņŃ”ŌńGC×°ÖĆ£¬Ņ»¶ØÖŹĮæѳʷ֊µĪČėĖ®·“Ó¦ŗó²ā¶ØÉś³ÉŃõĘųµÄĢå»ż»»ĖćĪŖ±ź×¼×“æö¼ĘĖćµĆµ½ŃõĘųĮ棬ŅĄ¾Ż»Æѧ·½³ĢŹ½¶ØĮæ¹ŲĻµ¼ĘĖćµĆµ½¹żŃõ»ÆÄĘÖŹĮ棬µĆµ½Ńõ»ÆÄĘÖŹĮæ·ÖŹż£»»ņĄūÓƱź×¼ŃĪĖįČÜŅŗµĪ¶Ø·“Ó¦ŗóČÜŅŗÖŠÉś³ÉµÄĒāŃõ»ÆÄʵÄĮ棬½įŗĻŌŖĖŲŹŲŗćĮŠŹ½¼ĘĖćµĆµ½Ńõ»ÆÄĘŗĶ¹żŃõ»ÆÄʵÄÖŹĮ棬µĆµ½Ńõ»ÆÄĘÖŹĮæ·ÖŹż£¬ŹµŃé¹ż³ĢÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½£¬ŹµŃéĖłŠčŅĒĘ÷£¬ŹµŃéĖłŠčŹŌ¼Į£¬ŹµŃéŠčÖ±½Ó²ā¶ØµÄÓŠ¹ŲĪļĄķĮæČē±ķĖłŹ¾£ŗ
| 2Na2O2+2H2O=4NaOH+O2”ü£¬ Na2O+H2O=2NaOH | A”¢D | b | ¢Ł·“Ó¦Ē°×¶ŠĪĘæ”¢ŃłĘ·ŗĶĖ®µÄ×ÜÖŹĮæ ¢Ś·“Ó¦ŗó׶ŠĪĘæŗĶČÜŅŗµÄ×ÜÖŹĮæ |
| 2Na2O2+2H2O=4NaOH+O2”ü£¬ Na2O+H2O=2NaOH | G”¢C | b | ĮæĶ²ÖŠŹÕ¼Æµ½µÄĘųĢåµÄĢå»ż |
| 2Na2O2+2H2O=4NaOH+O2”ü£¬ Na2O+H2O=2NaOH£¬ NaOH+HCl=NaCl+H2O | D”¢H | b”¢c”¢e | ÖŠŗĶ׶ŠĪĘæ֊ѳʷÓėĖ®·“Ó¦ŗóĖłµĆČÜŅŗŹ¹ÓƵÄŃĪĖį±ź×¼ČÜŅŗµÄĢå»ż |
| 2Na2O2+2H2O=4NaOH+O2”ü£¬ Na2O+H2O=2NaOH | A”¢D | b | ¢Ł·“Ó¦Ē°×¶ŠĪĘæ”¢ŃłĘ·ŗĶĖ®µÄ×ÜÖŹĮæ ¢Ś·“Ó¦ŗó׶ŠĪĘæŗĶČÜŅŗµÄ×ÜÖŹĮæ |
| 2Na2O2+2H2O=4NaOH+O2”ü£¬ Na2O+H2O=2NaOH | G”¢C | b | ĮæĶ²ÖŠŹÕ¼Æµ½µÄĘųĢåµÄĢå»ż |
| 2Na2O2+2H2O=4NaOH+O2”ü£¬ Na2O+H2O=2NaOH£¬ NaOH+HCl=NaCl+H2O | D”¢H | b”¢c”¢e | ÖŠŗĶ׶ŠĪĘæ֊ѳʷÓėĖ®·“Ó¦ŗóĖłµĆČÜŅŗŹ¹ÓƵÄŃĪĖį±ź×¼ČÜŅŗµÄĢå»ż |
µćĘĄ ±¾Ģāæ¼²éĪļÖŹµÄ×é³ÉĢ½¾æ£¬ĪŖøßĘµæ¼µć£¬ĢāÄæÄѶČÖŠµČ£¬ŹŌĢā²ąÖŲӌѧɜµÄ·ÖĪöÄÜĮ¦ŗĶŹµŃéÄÜĮ¦µÄ漲飬עÖŲÓŚĪļÖŹŠŌÖŹµÄ×ŪŗĻÓ¦ÓĆ£¬øł¾Ż·“Ó¦ĻÖĻóÕżČ·ÅŠ¶Ļ·“Ó¦²śĪļŹĒ½ā“š±¾ĢāµÄ¹Ų¼ü£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Mg2+/Mg | B£® | Cl/Cl- | C£® | N/O | D£® | Na+/F |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| n£ØSO₃2-£©£ŗ£¬n£ØHSO₃-£© | 91£ŗ9 | 1£ŗ1 | 1£ŗ91 |
| PH | 8.2 | 7.2 | 6.2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

 £®
£®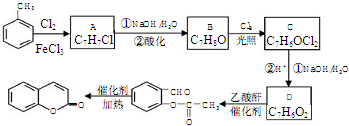
 £¬A”śBµÄ·“Ó¦ĄąŠĶŹĒČ”“ś·“Ó¦£®
£¬A”śBµÄ·“Ó¦ĄąŠĶŹĒČ”“ś·“Ó¦£® £©·“Ó¦£¬³żÉś³É
£©·“Ó¦£¬³żÉś³É Ķā£¬Ķ¬Ź±Éś³ÉµÄĮķŅ»ÖÖ²śĪļµÄ½į¹¹¼ņŹ½ŹĒCH3COOH£®
Ķā£¬Ķ¬Ź±Éś³ÉµÄĮķŅ»ÖÖ²śĪļµÄ½į¹¹¼ņŹ½ŹĒCH3COOH£® »„ĪŖĶ¬·ÖŅģ¹¹Ģ壬ĒŅ¾ßÓŠŅŌĻĀĢŲµć£ŗ
»„ĪŖĶ¬·ÖŅģ¹¹Ģ壬ĒŅ¾ßÓŠŅŌĻĀĢŲµć£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĪåÖÖ | B£® | ĖÄÖÖ | C£® | ČżÖÖ | D£® | ¶žÖÖ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 £»Š“³öA·Ö×ÓÖŠ¹ŁÄÜĶŵÄĆū³ĘōĒ»ł”¢ōČ»ł£»
£»Š“³öA·Ö×ÓÖŠ¹ŁÄÜĶŵÄĆū³ĘōĒ»ł”¢ōČ»ł£» £»
£»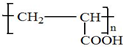 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 0.8mol•L-1 | B£® | 0.6mol•L-1 | C£® | 0.4mol•L-1 | D£® | 0.2mol•L-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| Ń”Ļī | »ÆѧŹ½ | µē×ÓŹ½»ņŗ¬ÓŠµÄ»Æѧ¼üĄąŠĶ | ĪļÖŹµÄŠŌÖŹ | ÓėŠŌÖŹĻą¶ŌÓ¦µÄÓĆĶ¾ |
| A | NaClO | Ąė×Ó¼ü ¹²¼Ū¼ü | ĒæŃõ»ÆŠŌ | Ļū¶¾¼Į |
| B | H2O2 | 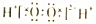 | ²»ĪČ¶Ø£¬Ņ×·Ö½ā | Ņ½ÓĆĻū¶¾¼Į |
| C | NH3 | ¹²¼Ū¼ü | Ė®ČÜŅŗ³ŹČõ¼īŠŌ | ¹¤ŅµÖĘĻõĖį |
| D | NaHCO3 | Ąė×Ó¼ü | ŹÜČČŅ×·Ö½ā | ÅŻÄĆš»šĘ÷ |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com