

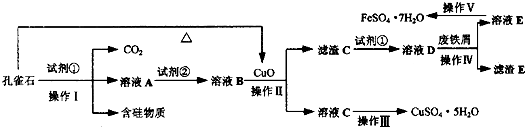
请回答下列问题:
(1)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择。“实验步骤中试剂①为___________(填代号),检验溶液A中Fe3+的最佳试剂为______________(填代号)。
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、___________、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是________________。
(3)制备CaCO3时,应向CaCl2溶液中先通入(或先加入)___________(填化学式)。若实验过程中有氨气逸出,应选用下列___________装置回收(填代号)。

(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应___________,直到___________。用KMnO4标准溶液滴定时应选用___________滴定管(填“酸式”或“碱式”)。
(1)c d
(2)冷却结晶 引流
(3)NH3·H2O b
(4)平视凹液面(或平视刻度线) 凹液面的最低点与刻度线相切 酸式
解析:本题考查除杂、过滤、尾气吸收、溶液配制、中和滴定等实验知识,要求知识掌握准确、运用熟练。(1)由图中转化关系可知,试剂①的目的是将Fe2+氧化为Fe3+,考虑到不引入新杂质,试剂①应选H2O2,检验Fe3+的最佳试剂为KSCN。(2)由CuSO4溶液得到CuSO4·5H2O需经过加热蒸发、冷却结晶、过滤等操作,过滤时玻璃棒的作用是引流。(3)要使CaCl2溶液中生成CaCO3,须在溶液显碱性的条件下通CO2,为使溶液显碱性,可向溶液中加氨水或通NH3;NH3极易溶于水,吸收多余NH3时要防止倒吸。(4)KMnO4有强氧化性,能腐蚀橡皮管,所以盛放KMnO4溶液要用酸式滴定管。


 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:

| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 2.7 | 3.7 |
| Fe2+ | 7.6 | 9.6 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com