
【题目】CaCO3广泛存在于自然界,是一种重要的化工原料。实验室用大理石(主要成分为CaCO3,另外有少量的含硫化合物)和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。
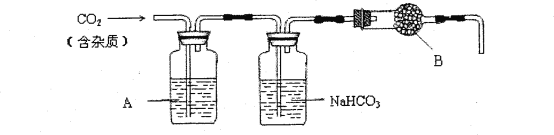
完成下列填空:
(1)用浓盐酸配制1:1(体积比)的稀盐酸(约6mol·L—1),应选用的仪器是____。
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶
上述装置中,A是___溶液,NaHCO3溶液可以吸收____。上述装置中,B物质是____。用这个实验得到的气体测定CO2的分子量,如果B物质失效,测定结果____(填“偏高”、“偏低”或“不受影响”)。
(2)SiO2与CO2组成相似,但固体的熔点相差甚大,其原因是_____。
(3)饱和的Na2CO3溶液中通入过量CO2的离子方程式为_____。0.1mol/L的NaHCO3溶液中,c(Na+)+c(H+)=_____,其中有关碳微粒的关系为:____ =0.1mol/L。浓度相等的Na2CO3和NaHCO3溶液等体积混合后,溶液中离子浓度由大到小的关系为______。
【答案】abc CuSO4溶液或酸性KMnO4溶液 吸收HCl气体或吸收酸性气体 无水CaCl2 偏低 其原因是所属晶体类型不同,二氧化硅是原子晶体,熔化时破坏化学键,熔点高;二氧化碳是分子晶体,熔化时破坏的是分子间作用力,熔点低 2Na++CO32-+CO2+H2O=2NaHCO3↓ c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-) c(CO32-)+c(HCO3-)+c(H2CO3) c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
【解析】
(1)配制一定体积比的溶液时,应选用烧杯、玻璃棒和量筒,用量筒量出相同体积的浓盐酸和水,倒入烧杯中,用玻璃棒搅拌加速溶解;根据实验所用药品,制得的气体中可能含有H2S、HCl和水蒸气;根据除杂的要求,除去H2S是可选用CuSO4溶液或酸性KMnO4溶液;碳酸氢钠溶液用于吸收HCl气体或吸收酸性气体;B是用来除去水份的,但这种干燥剂又不能与CO2反应所以是氯化钙;如果B中物质失效则二氧化碳中含有水,而水的相对分子质量小于二氧化碳,所以测定结果会偏低;
(2)二氧化硅与二氧化碳所属晶体类型不同,二氧化硅是原子晶体,熔化时破坏共价键,熔点高,而二氧化碳是分子晶体,熔化时破坏的是分子间作用力,熔点低,导致SiO2与CO2熔点相差甚大;
(3)向饱和Na2CO3溶液中通入足量CO2,发生反应Na2CO3+CO2+H2O=2NaHCO3,Na2CO3溶解度大于NaHCO3,则NaHCO3溶液为过饱和溶液,所以生成NaHCO3沉淀导致溶液变浑浊,离子方程式:2Na++CO32-+H2O+CO2=2NaHCO3↓;在0.1mol/L的NaHCO3溶液中,存在的电荷守恒式为c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),存在的物料守恒式为c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol/L;浓度相等的Na2CO3和NaHCO3溶液等体积混合后,溶液中Na+浓度最大,CO32-的水解程度大于HCO3-水解程度,即c(CO32-)<c(HCO3-),且溶液显碱性,即c(H+)<c(OH-),则溶液中各离子浓度的由大到小的关系为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】已知:FeCl3(aq)+3KSCN(aq)![]() 3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是
3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是

A.A点与B点相比,A点的c(Fe3+)大
B.加入KCl固体可以使溶液由D点变到C点
C.反应处于D点时,一定有υ(正)<υ(逆)
D.若T1、T2温度下的平衡常数分别为K1、K2,则K1<K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一个碳原子连两个—OH的结构不稳定,会很快脱去一分子水,其变化如下:
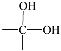 →
→ ![]() + H2O
+ H2O
下图中B和![]() 、
、![]() 等都是A和Cl2发生反应生成的产物,E是一种高分子化合物,透光性能好,常用作一些灯饰外壳。过程中一些小分子都已经略去。
等都是A和Cl2发生反应生成的产物,E是一种高分子化合物,透光性能好,常用作一些灯饰外壳。过程中一些小分子都已经略去。
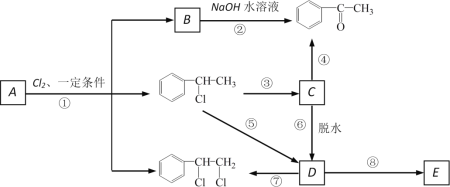
(1)A的化学名称为_____________
(2)第⑦步的化学方程式为___________________________,该反应类型为_____;
(3)E的结构简式为______;
(4)符合下列条件:苯环上有两个取代基且苯环上只有两种不同化学环境的氢的C的同分异构体的结构简式分别是_______________、_____________、________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现电极与试纸接触处出现一个双色同心圆,内圆为白色,外圆呈浅红色。则下列说法正确的是
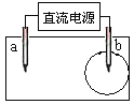
A.b电极是阴极B.a电极与电源的正极相连接
C.电解过程中,水是还原剂D.a电极附近溶液的pH变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异丙苯[![]() ]是一种重要的化工原料,下列关于异丙苯的说法不正确的是( )
]是一种重要的化工原料,下列关于异丙苯的说法不正确的是( )
A. 异丙苯是苯的同系物
B. 可用酸性高锰酸钾溶液区别苯与异丙苯
C. 在光照的条件下,异丙苯与Cl2发生取代反应生成的氯代物有三种
D. 在一定条件下能与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1L的密闭容器中,发生反应N2+3H2![]() 2NH3△H<0,投入1molN2和3molH2分别在以下不同实验条件下进行反应。下列分析正确的是( )
2NH3△H<0,投入1molN2和3molH2分别在以下不同实验条件下进行反应。下列分析正确的是( )
容器编号 | 实验条件 | 平衡时反应中的能量变化 |
I | 恒温恒容 | 放热Q1kJ |
II | 恒温恒压 | 放热Q2kJ |
Ⅲ | 恒容绝热 | 放热Q3kJ |
A.放出热量:Q1>Q2
B.N2的转化率:I>Ⅲ
C.平衡时H2的浓度:I>Ⅲ
D.平衡时氨气的体积分数:I>II
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从溴乙烷制取1,2二溴乙烷,下列制备方案中最好的是( )
A. CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH2=CH2
CH2=CH2![]() CH2BrCH2Br
CH2BrCH2Br
B. CH3CH2Br![]() CH2BrCH2Br
CH2BrCH2Br
C. CH3CH2Br![]() CH2=CH2
CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH2BrCH2Br
CH2BrCH2Br
D. CH3CH2Br![]() CH2=CH2
CH2=CH2![]() CH2BrCH2Br
CH2BrCH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3—CH=CH2+HBr―→CH3—CHBr—CH3(主要产物)。1 mol某烃A充分燃烧后可以得到8 mol CO2和 4 mol H2O。该烃A在不同条件下能发生如下图所示的一系列变化。
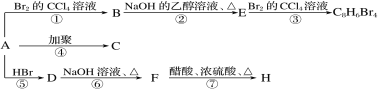
(1)A的化学式:________,A的结构简式:________。
(2)上述反应中,①是________反应(填反应类型,下同),⑦是________反应。
(3)写出C、D、E、H物质的结构简式:
C____________________,D_____________________,
E____________________,H_____________________。
(4)写出D―→F反应的化学方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与碳元素同周期的核外电子排布中有 3 个未成对电子的元素在第二周期________族, 该元素的气态氢化物的电子式为_______,其空间构型是______,是含________共价键的____分子(填极性或非极性)。该气体溶于水后,水溶液呈_____性(填“酸”或“碱”)原因是____(用方程式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com