
分卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的__________区;溴原子基态的价电子排布式为____________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是__________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是__________(写出名称)。
| 氟 | 氯 | 溴 | 碘 |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为____________,写出一个ClO2-的等电子体__________。
(5)下图为碘晶体晶胞结构。有关说法中正确的是_________。
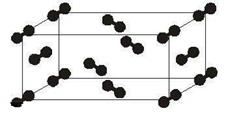
碘晶体晶胞
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子交替形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
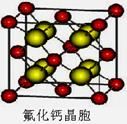
(6)已知CaF2晶体(见下图)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:选择题
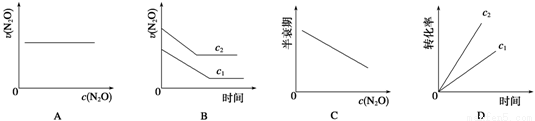
在一定条件下,N2O分解的部分实验数据如下:
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
c(N2O)/mol· | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 |
反应时间/min | 60 | 70 | 80 | 90 | 100 | |
c(N2O)/mol·L-1 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
下图能正确表示该反应有关物理量变化规律的是 ( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
查看答案和解析>>
科目:高中化学 来源:2017届江苏省淮安市高三12月考试化学试卷(解析版) 题型:填空题
(1)最近有人利用反应“2C4H10+13O2=8CO2+10H2O”制造了一种燃料电池,一个电极通入空气,另一电极通入丁烷,电池的电解质是掺杂了Y2O3(三氧化 二钇)的ZrO2(二氧化
二钇)的ZrO2(二氧化 锆)晶体,它在高温下能传导O2-。试回答下列问题:
锆)晶体,它在高温下能传导O2-。试回答下列问题:
固体电解质中的O2-向 极移动(填“正”或“负”);写出该燃料电池的电极反应式:电池正极 ;电池负极 。
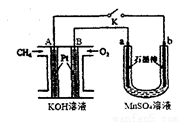
(2)用如图装置电解MnSO4溶液制MnO2时,A极为: 极, A电极电极反应式为 ;a极为: 极,电解MnSO4溶液制MnO2的化学方程式 。电解一段时间后, 溶液的pH将 (填“增大”、“减小”或“不变”)。
(3)精炼铜时,粗铜应与直流电源的____________极(填“正”或“负”)相连,阴极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2017届广东省七校联合体高三上学期第二次联考化学试卷(解析版) 题型:推断题
【化学—选修5:有机化学基础】聚酯增塑剂广泛应用于耐油电缆、煤气管、防水卷材、电气胶带;耐油耐汽油的特殊制品等。聚酯增塑剂G及某医药中间体H的一种合成路线如下(部分反应条件略去):
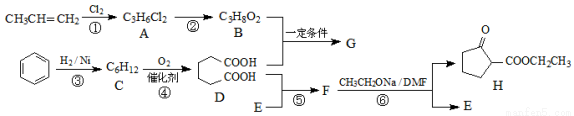
已知:

(1)B的名称(系统命名)为 。
(2)若反应①的反应条件为光照,最先得到的氯代有机物结构简式是 。
(3)写出下列反应的反应类型:反应②是 ,反应④是 。
(4)写出B与D反应生成G的反应方程式 。
(5)甲苯的二氯代物产物的同分异构体有 种。
(6)利用以上合成路线的信息,以甲苯和乙醇为原料合成下面有机物(无机试剂任选)。
请写出合成路线: 。
查看答案和解析>>
科目:高中化学 来源:2017届广东省七校联合体高三上学期第二次联考化学试卷(解析版) 题型:选择题
如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列分析正确的是
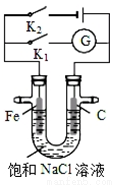
A.K1闭合,铁棒上发生的反应为2H+ + 2e﹣= H2↑
B.K1闭合,石墨棒周围溶液pH逐渐降低
C.K2闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
D.K2闭合,电路中通过0.4NA个电子时,两极共产生4.48L气体
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上12月月考化学卷(解析版) 题型:填空题
氧化还原反应在生产生活中有着重要的应用。请按要求写出相应的方程式。
⑴将含SO2的废气通入含Fe2+(催化剂)的溶液中,常温下可使SO2转化为SO2-4,其总反应为2SO2+O2+2H2O=2H2SO4。上述总反应分两步进行,第一步反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,写出第二步反应的离子方程式: 。
⑵pH=3.6时,碳酸钙与硫酸铝反应可制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液。若溶液的pH偏高,则碱式硫酸铝产率降低且有气泡产生,用化学方程式表示其原 因: 。
因: 。
⑶ClO2是一种高效安全的杀菌消毒剂。氯化钠电解法生产ClO2工艺原理示意图如下:
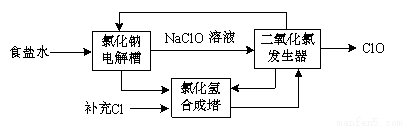
①写出氯化钠电解槽内发生反应的离子方程式: 。
②写出ClO2发生器中的化学方程式,并标出电子转移的方向及数目: 。
③ClO2能将电镀废水中的CN-离子氧化成两种无毒气体,自身被还原成Cl-。写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上12月月考化学卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,11.2 L CCl4中含有的分子数为0.5NA
B.在Na2O2与水的反应中,每生成1 mol O2,转移电子的数为2NA
C.常温常压下,7.8 g苯中含有双键的数目为0.3NA
D.25℃时,0.1 mol·L-1 NH4NO3溶液中含有的铵根离子数为0.1NA
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上模拟四化学试卷(解析版) 题型:选择题
关于下列各装置图的叙述中,正确的是
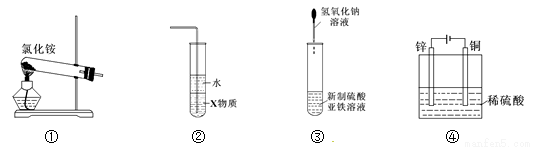
A.实验室用装置①制取氨气
B.装置②中X若为四氯化碳,可用于吸收氨气,并能防止倒吸
C.装置③可用于制备氢氧化亚铁并观察其颜色
D.装置④是电解池,锌电极为正极,发生氧化反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一月考二化学卷(解析版) 题型:填空题
向浓度相等、体积均为50 mL 的 A、B 两份NaOH 溶液中,分别通入一定量的CO2后,再稀释到100 mL。
(1)在 NaOH 溶液中通入一定量的 CO2 后,溶液中溶质的可能组成是
①_________, ②________, ③________, ④________。
(2)在稀释后的溶液中逐滴加入0.2 mol/L 的盐酸,产生 CO2 的体积(标准状况)与所加盐酸的体积关系如图所示。
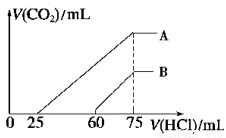
①A 曲线表明,原溶液通入CO2后,所得溶质与盐酸反应产生 CO2 的最大体积是_____mL(标准状况)。
②B 曲线表明,原溶液通入CO2后,所得溶液中溶质的化学式为______________。
③原 NaOH 溶液的物质的量浓度为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com