

分析 CeO2、SiO2、Fe2O3等中加入稀硫酸,Fe2O3转化FeCl3存在于滤液中,滤渣为CeO2和SiO2;②加入稀硫酸和H2O2,CeO2转化为Ce3+,滤渣为SiO2;③加入碱后Ce3+转化为沉淀,④通入氧气讲Ce从+3氧化为+4,得到产品,
(1)萃取剂与水不互溶,结合萃取原理分析;
(2)步骤①反应为氧化铁溶于硫酸反应生成硫酸铁和水,CeO2具有氧化性能氧化氯离子为氯气;
(3)根据滤渣A上含有FeCl3;取最后一次洗涤液,加入KSCN溶液,若不出现红色,则已洗净,反之,未洗净,根据氧化还原反应中电子得失守恒来分析;
(4)工业上利用上述回收的资源以及焦炭、氯气、氢气制取纯硅,碳和二氧化硅反应生成粗硅和一氧化碳,粗硅和氯气反应生成四氯化硅,四氯化硅和氢气反应生成氯化氢和晶体硅;
(5)根据电子守恒建立关系式:Ce(OH)4~FeSO4,然后进行计算求出Ce(OH)4的质量,最后求出质量分数.
解答 解:(1)化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP应满足的条件是:TBP不溶于水且铈离子在TBP溶解度更大,
故答案为:TBP不溶于水且铈离子在TBP溶解度更大;
(2)步骤①反应为氧化铁溶于硫酸反应生成硫酸铁和水,步骤①反应的离子方程式:Fe2O3+6H+═2Fe3++3H2O,第①步不能用浓盐酸的理由是CeO2与盐酸反应,CeO2具有氧化性能氧化氯离子为氯气,
故答案为:Fe2O3+6H+═2Fe3++3H2O;CeO2与盐酸反应,放出氯气;
(3)滤渣A上含有FeCl3,洗涤滤渣A的目的是为了除去Fe3+、Cl-;取最后一次洗涤液,加入KSCN溶液,若不出现红色,则已洗净,反之,未洗净,稀硫酸、H2O2,CeO2三者反应生成转化为Ce2(SO4)3、O2和H2O,反应的化学方程式为:2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O,
故答案为:取最后一次洗涤液,加入KSCN溶液,若不出现红色,则已洗净,反之,未洗净或取最后洗涤液少量,滴加AgNO3,如无白色沉淀,则洗干净;2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O;
(4)工业上利用上述回收的资源以及焦炭、氯气、氢气制取纯硅,碳和二氧化硅反应生成粗硅和一氧化碳,粗硅和氯气反应生成四氯化硅,四氯化硅和氢气反应生成氯化氢和晶体硅,反应的化学方程式为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si(粗硅),Si(粗硅)+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SiCl4;SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si(纯硅)+4HCl,
故答案为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si(粗硅),Si(粗硅)+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SiCl4;SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si(纯硅)+4HCl;
(5)用0.1000mol/LFeSO4溶液滴定至终点,铈被还原成Ce3+,则Fe2+被氧化为Fe3+,则
Ce(OH)4~FeSO4
0.002mol 0.1000mol/L-1×0.020L
所以m(Ce(OH)4)=0.002mol×208g/mol=0.416g,
产品中Ce(OH)4的质量分数为$\frac{0.416}{0.500}$×100%=83.2%,
故答案为:83.2%;
点评 本题以工艺流程为基础,考查化学实验基本操作、元素及化合物知识、化学计算、氧化还原反应等相关知识,题目难度中等,明确实验流程及反应原理为解答关键,试题有利于培养学生的分析、理解能力及化学实验、化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
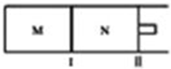 如图所示,隔板I固定不动,活塞II可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)?xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
如图所示,隔板I固定不动,活塞II可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)?xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )| A. | 若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N) | |
| B. | 若x<3,C的平衡浓度关系为:c(M)<c(N) | |
| C. | 若x>3,达到平衡后B的转化率关系为:α(M)>α(N) | |
| D. | x不论为何值,平衡时M、N中的平均相对分子质量都相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用新制Cu(0H)2悬浊液不能鉴别麦芽糖和蔗糖 | |
| B. | 硫酸铵和醋酸铅溶液均可使鸡蛋清溶液中的蛋白质变性 | |
| C. | 油是不饱和高级脂肪酸的简单甘油酯,是纯净物 | |
| D. | 用银镜反应可证明蔗糖是否转化为葡萄糖,但不能证明是否完全转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与浓硝酸、浓硫酸水浴加热并保持55~60℃反应生成硝基苯 | |
| B. | 乙醇在浓硫酸作催化剂和脱水剂且加热至170℃时发生消去反应生成乙烯 | |
| C. | 溴乙烷在氢氧化钠醇溶液中加热发生消去反应生成乙烯 | |
| D. | 甲苯与氯气在光照下反应主要生成2,4二氯甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖和蛋白质等高分子化合物是人体必需的营养物质 | |
| B. | 将草木灰和硫酸铵混合施用,肥效更高 | |
| C. | 用二氧化碳生产聚碳酸酯可以减少碳排放,以减缓温室效应 | |
| D. | 棉花的主要成分是纤维素,石英玻璃、陶瓷和水泥均属于硅酸盐产品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuCl2[CuSO4] | B. | NaCl[HCl] | C. | NaOH[Na2O] | D. | CuSO4[Cu(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
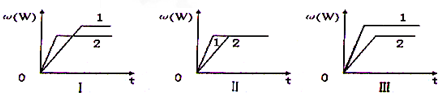
| A. | 图I可能是不同压强对反应的影响,且p2>p1,a+b>n | |
| B. | 图I可能是不同温度对反应的影响,且T2>T1,△H>0 | |
| C. | 图II可能是不同压强对反应的影响,且p1>p2,n=a+b | |
| D. | 图Ⅲ可能是不同温度对反应影响,且T1>T2,△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 逆反应速率一定增大 | B. | 该反应的条件一定发生变化 | ||
| C. | 反应物的转化率一定增大 | D. | 平衡一定向正反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com