
【题目】下列有关化学与自然资源的开发利用说法中不正确的是( )
A. 海水提溴是将海水中的化合态的溴富集再转化为游离态的溴
B. 石油裂化的主要目的是提高汽油的产量
C. 煤干馏的产品很多,是一个化学変化
D. 海水提镁的过程为:MgCl2(aq)![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
【答案】D
【解析】
A、根据工业上海水中提取溴的方法判断;
B、石油裂化的主要目的是将长的碳链断裂成短的碳链,得到汽油;
C、煤干馏是将煤隔绝空气加强热,产生很多新物质;
D、海水提镁的过程中从海水中得到氯化镁,再电解熔融的氯化镁得镁;
A、海水中加入氧化剂,把溴离子氧化为溴单质,也就是先将海水中的化合态的溴富集再转化为游离态的溴,故A正确;
B、石油裂化的主要目的是将长的碳链断裂成短的碳链,得到汽油,以提高汽油的产量,故B正确;
C、煤干馏是将煤隔绝空气加强热,产生很多新物质(煤焦油、粗氨水、焦炉气等),所以是化学变化,故C正确;
D、海水提镁的过程中:把氢氧化镁与盐酸反应变为氯化镁,然后再电解熔融的氯化镁得到镁,故D错误;
正确选项D。


科目:高中化学 来源: 题型:
【题目】硫是生物必需的大量营养元素之一,下图是自然界中硫的循环图,请分析此图并回答有关问题。

(1)氮循环和硫循环是自然界中两种重要的元素循环过程,下列关于这两种循环的说法正确的是________。
选项 | 比较 | 氮循环 | 硫循环 |
A | 异 | 氮元素会进入大气 | 硫元素不会进入大气 |
B | 氮循环过程有生物圈参与 | 硫循环过程无生物圈参与 | |
C | 同 | 人类活动对氮循环和硫循环都造成巨大影响 | |
D | 氮循环和硫循环对环境的影响是都能导致温室效应 | ||
(2)分解者可将含硫有机物分解为H2S,硫磺细菌和硫化细菌可将H2S进一步变为硫单质或硫酸盐,下列关于硫化氢说法正确的是_______。
A.H2S分子很稳定,受热难分解
B. H2S分子中所有原子的最外层都达到8电子结构
C.将H2S通入FeSO4溶液,产生沉淀
D.H2S中硫元素为-2价,因此H2S只有还原性,没有氧化性
E.H2S是一种无色臭鸡蛋气味的有毒气体
(3)大气中的SO2经过一系列转化最终生成H2SO4,导致降水具有较强酸性,称为酸雨。检验某次降雨是否为酸雨的方法是_________________,收集某次酸雨样品,发现8小时内,样品pH一直在减小,其原因可能是________________。(用化学方程式表示)
(4)为了防治酸雨,工业上常采用“钙基固硫法”即将生石灰和含硫的煤混合后燃烧,燃烧时硫、氧气和生石灰共同作用,使硫元素转移到炉渣中,大部分硫元素最终转化为固体盐是_______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图所示;下列描述错误的是:

A. 淡化海水的方法主要有蒸馏法、电渗析法、离子交换法
B. 以NaCl为原料可以生产烧碱、纯碱、金属钠、氯气、盐酸等化工产品
C. 步骤Ⅱ中鼓入热空气吹出溴,是因为溴蒸气的密度比空气的密度小
D. 用SO2水溶液吸收Br2的离子反应方程式为:Br2+SO2+2H2O═4H++SO42﹣+2Br﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是
A. CuS的溶解度大于PbS的溶解度
B. 原生铜的硫化物具有还原性,而铜蓝没有还原性
C. CuSO4与ZnS反应的离子方程式是![]()
![]() CuS↓
CuS↓
D. 整个过程涉及的反应类型有氧化还原反应和复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿斯巴甜(Aspartame)是一种具有清爽甜味的有机化合物,结构简式如图所示。下列说法不正确的是

A. 阿斯巴甜属于氨基酸,分子式为C14H18N2O5
B. 阿斯巴甜能发生氧化、取代、消去等反应
C. 阿斯巴甜分子的核磁共振氢谱共有11种吸收峰
D. 阿斯巴甜在一定条件下既能与酸反应,又能与碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是25 ℃时几种难溶电解质的溶解度:
难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子。例如:
①为除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=a,过滤结晶即可。
请回答下列问题:
(1)上述三种除杂方案都能够达到很好的效果,Fe3+、Fe2+都被转化为__________________(填化学式)而除去。
(2)①中加入的试剂应该选择__________为宜,其原因是______________________________。
(3)②中除去Fe3+所发生的总反应的离子方程式为____________________________________。
(4)已知Fe(OH)3的Ksp=1×10-35 ;化学上通常认为残留在溶液中离子浓度小等于1×10-5mol/L时,沉淀完全。方案③中a最小值为________________。
(5)下列与方案③相关的叙述中,正确的是___________________________(填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=a可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=a的溶液中
E.在pH>a的溶液中Fe3+一定不能大量存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层上电子数是K层上电子数的3倍 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素X位于元素周期表的第____周期第__族,它的一种核素可测定文物年代,这种核素的符号是____。
(2)元素Y的原子结构示意图为___,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法_____。
(3)元素Z与元素T相比,非金属性较强的是___(用元素符号表示),下列表述中能证明这一事实的是___。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是____,理由______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于ΔH的说法正确的是 ( )
A.在任何条件下,化学反应的焓变都等于化学反应的反应热
B.ΔH>0时反应放热,ΔH<0时反应吸热
C.ΔH越大,说明反应放出的热量越多
D.一个化学反应中,当反应物能量大于生成物能量时,反应放热,ΔH为“-”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。工业上常采用催化还原法和碱吸收法处理SO2气体。

(1)如图所示:1mol CH4完全燃烧生成气态水的能量变化和1mol S(g)燃烧的能量变化。在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式________________________________________________________。
(2)焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g) ![]() S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变 化的关系如图所示:
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变 化的关系如图所示:
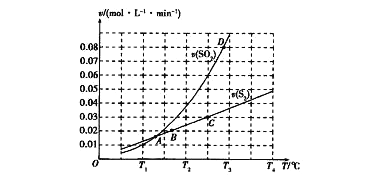
①A、B、C、D四点对应的状态中,达到平衡状态的有_____________(填字母)。
②该反应的△H_____0(填“>”“<”或“=”)。
③下列措施能够增大SO2平衡转化率的是______________。
A.降低温度 B.增加C的量 C.减小容器体积 D.添加高效催化剂
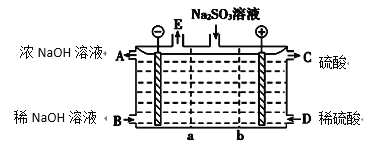
(3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴、阳膜组合电解装置如图所示,电极材料为石墨。
①a表示________(填“阴”或“阳”)离子交换膜。A~E分别代表生产中的原料或产品,其中A为浓氢氧化钠溶液,C为硫酸溶液,E表示________(写化学式)。
②电解过程中,阳极的电极反应式为_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com