
【题目】由反应物 X 转化为 Y 或 Z 的能量变化如图所示。下列说法正确的是
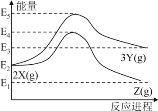
A.由 X→Y 反应的 ΔH=E5-E2
B.由 X→Z 反应的 ΔH=E2-E1
C.反应 2X(g)=3Y(g)的活化能=E3-E2
D.2X(g)=Z(s) ΔH<(E1-E2) kJ·molˉ1
科目:高中化学 来源: 题型:
【题目】文物是人类宝贵的历史文化遗产,我国文物资源丰富,但保存完好的铁器比青铜器少得多,研究铁质文物的保护意义重大。

(1)铁刃铜钺中,铁质部分比铜质部分锈蚀严重,其主要原因是________。
(2)已知:
ⅰ.铁质文物在潮湿的土壤中主要发生吸氧腐蚀,表面生成疏松的FeOOH;
ⅱ.铁质文物在干燥的土壤中表面会生成致密的Fe2O3,过程如下。
![]()
①写出ⅰ中,O2参与反应的电极反应式和化学方程式:________、________。
②若ⅱ中每一步反应转化的铁元素质量相等,则三步反应中电子转移数之比为________。
③结合已知信息分析,铁质文物在潮湿的土壤中比在干燥的土壤中锈蚀严重的主要原因是________。
(3)(资料1)Cl–体积小穿透能力强,可将致密氧化膜转化成易溶解的氯化物而促进铁质文物继续锈蚀。
(资料2)Cl–、Br–、I–促进铁器皿继续锈蚀的能力逐渐减弱。
①写出铁质文物表面的致密氧化膜被氯化钠破坏的化学方程式________。
②结合元素周期律解释“资料2”的原因是________。
(4)从潮湿土壤出土或海底打捞的铁质文物必须进行脱氯处理:用稀NaOH溶液反复浸泡使Cl-渗出后,取最后一次浸泡液加入试剂 ________(填化学式)检验脱氯处理是否达标。
(5)经脱氯、干燥处理后的铁质文物再“覆盖”一层透明的高分子膜可以有效防止其在空气中锈蚀。下图为其中一种高分子膜的片段:
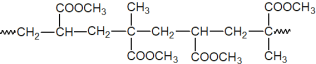
该高分子的单体是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某合金粉末除含铝外,还含有铁、铜中的一种或两种,某兴趣小组在老师的指导下,对合金中铁、铜的存在情况进行了如下探究。
(查阅资料)铁、铜不与氢氧化钠溶液反应。
(猜想)猜想1:该合金粉末中,除含铝外,还含有铁。
猜想2:该合金粉末中,除含铝外,还含有铜。
猜想3:该合金粉末中,除含铝外,还含有_________(填名称)。
(实验探究)下列实验仅供选择的试剂是:10%的盐酸、30%的氢氧化钠溶液。
实验方案 | 实验现象 | 结论 |
①取一定量的合金粉末,加过量的____,充分反应后过滤,滤渣备用。 | 粉末部分溶解,并有气体放出。 | 合金中一定含有铝。 |
②取步骤①所得滤渣,加过量的______,充分反应。 | 滤渣粉末部分溶解,并有气体放出,溶液呈现浅绿色。 | 合金中一定含有______。 |
(探究结论)猜想3成立。
(反思)一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质。写出铝与氢氧化钠溶液反应的离子方程式__________。
(知识延伸)在一定条件下,铁和铝都能与水反应。写出在相应条件下,铁和水发生反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某二元酸H2MO4在水中电离分以下两步:H2MO4H++HMO4-,HMO4-H++MO42-。常温下向20 mL0.1mol/L NaHMO4溶液中滴入cmol/LNaOH溶液,溶液温度与滴入NaOH溶液体积关系如图。下列说法正确的是

A.该氢氧化钠溶液pH=12
B.图像中F点对应的溶液中c(OH-)>c(HMO4-)
C.滴入NaOH溶液过程中水的电离程度一直增大
D.图像中G点对应的溶液中c(Na+)=c(HMO4-)+2c(MO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述正确的是( )
A.标准状况下,分子数为NA的CO、N2混合气体体积约为22.4L,质量为28g
B.25℃、101.3kPa时,11.2LH2中含有的原子数为NA
C.10 mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8%
D.1mol/L Na2SO4溶液中离子总数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种水系锌离子电池总反应式为xZn+Zn1-xMn2O4![]() ZnMn2O4.(0<x<1)。下列说法错误的是( )
ZnMn2O4.(0<x<1)。下列说法错误的是( )
A.充电时,阳极的电极反应式为Zn1-xMn2O4+xZn2++2xe-=ZnMn2O4
B.放电时,Zn2+向正极迁移
C.充放电过程中锌与锰的化合价都发生变化
D.放电时,每转移1mole-正极质量增加32.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如图所示(部分反应物或生成物未列出),其中E为白色沉淀,I为红褐色沉淀。
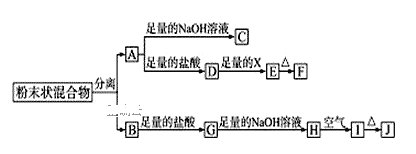
(1)写出下列物质的化学式:F___,G___。
(2)分离粉末状混合物最简单的方法是___。
(3)D→E转化中,加入足量的X,试剂X可能是___,写出其离子方程式___。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)A→C的离子方程式___。
(5)检验G溶液中的阳离子的方法___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O,以下叙述正确的是( )
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A. Cl2既做氧化剂又做还原剂
B. 被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1
C. Cl2是氧化剂,NaOH是还原剂
D. 氧化剂得电子数与还原剂失电子数之比为5∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家刚刚发现了某种元素的原子,1个该原子质量是a g,一个12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是( )
①该原子的相对原子质量为![]() ②m g该原子的物质的量为
②m g该原子的物质的量为![]() mol ③该原子的摩尔质量是a NA g ④W g该原子中含有
mol ③该原子的摩尔质量是a NA g ④W g该原子中含有![]() 个该原子⑤由已知信息可得:NA=
个该原子⑤由已知信息可得:NA=![]()
A.①③⑤B.②③④C.①②⑤D.①②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com