
分析 对于平衡状态的建立,只与条件相关,即与温度、压强(或容器的容积)、反应物或生成物的起始量的相对关系有关,而与反应进行的方向无关,因此对于该条件下的反应,初始态是2 mol SO2和1 mol O2的混合物,或是2 mol纯净的SO3,两者是等价的,最终到达的平衡状态完全相同.
(1)将初始物质的加入量转换为相当于a=2,b=1,就可以达到题设的平衡状态,据此计算.
(2)中要求将具体问题抽象为普遍规律,此时必须把握“把所有初始物都转换为反应物,则必须相当于2 mol SO2和1 mol O2的混合物,把所有的初始物转换为生成物,则必须相当于2 mol纯净的SO3”.才能得出正确结论:必须同时满足a+c=2和2b+c=2两个关系式.
解答 解:设起始时2摩SO2和1摩O2为Ⅰ状态,其它条件为Ⅱ状态,温度不变,体积不变时,
根据改变起始加入量情况,则只要通过可逆反应的化学计量数比换算(极限假设转换)成反应方程式左(或右)的同一边物质的物质的量与原平衡相同即可.
(1)2SO2+O2?2SO3
Ⅰ2mol 1mol 0
Ⅱ0.5mol bmol cmol
则有:0.5+c=2;b+$\frac{c}{2}$=1,解之得:b=0.25 mol,c=1.5 mol,
故答案为:b=0.25;
(2)2SO2+O2?2SO3
Ⅰ2mol 1mol 0
Ⅱa b c
当SO2和SO3的物质的量之和为2 mol时,才能保证反应初始SO2的物质的量为2mol,即a+c=2mol,此时要求O21mol,那么就有b+0.5c=1mol.
满足此两条件方可使平衡与题说平衡完全相同,故答案为:a+c=2;2b+c=2.
点评 本题是对可逆反应和化学平衡状态的理解以及利用题给信息将化学问题以及内在规律抽象为数学问题,利用数学工具解决化学问题的思维能力的综合考查.做题时注意在定温(T)、定容(V)条件下,建立的两平衡体系中不仅同种物质的百分含量相等,而且物质的量浓度、物质的量也分别相等.


科目:高中化学 来源: 题型:选择题
 已知NH3和HCl都能用来作喷泉实验的气体,若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集HCl和N2的混合气体,如图所示,喷泉实验停止后,两个烧瓶内溶液的溶质的物质的量浓度(c)和溶质的质量分数(w)关系是( )
已知NH3和HCl都能用来作喷泉实验的气体,若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集HCl和N2的混合气体,如图所示,喷泉实验停止后,两个烧瓶内溶液的溶质的物质的量浓度(c)和溶质的质量分数(w)关系是( )| A. | c和w都不同 | B. | c和w都相同 | C. | c相同,w不同 | D. | w相同,c不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
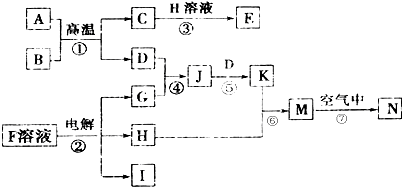
 ,N的化学式为Fe(OH)3.
,N的化学式为Fe(OH)3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 推论 |
| A | 含Ag+离子的溶液中滴加氯化钡溶液会产生白色沉淀 | 滴加氯化钡溶液产生白色沉淀的溶液中不一定含有Ag+离子 |
| B | 常温下铜与浓硝酸可以制取NO2 | 常温下铁与浓硝酸也可以制取NO2 |
| C | Fe(OH)3固体中滴加稀盐酸生成氯化铁和水 | Fe(OH)3固体中滴加氢碘酸生成碘化铁和水 |
| D | 铜片不溶于稀硫酸 | 铜片也不溶于稀硝酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则表示氢气燃烧热的热化学方程式为2H2 (g)+O2 (g)═2H2O(l)△H=-571.6 kJ/mol | |
| C. | 酸与碱恰好完全反应生成正盐的c(H+)=c(OH-)=10-6 mol/L的溶液一定呈中性 | |
| D. | 温度、浓度的改变一定会引起反应速率的改变,所以化学平衡一定会移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液显电中性,胶体带有电荷,所以胶体较稳定 | |
| B. | 胶体粒子能透过滤纸,但不能透过半透膜,所以可用渗析的方法精制胶体 | |
| C. | 可用丁达尔效应区分溶液和胶体 | |
| D. | 电泳实验说明了胶体粒子能吸附溶液中的阳离子或阴离子而带有电荷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①②③ | C. | ①②④ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com