
 某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如下图.材料1:NH3是强还原剂,能将某些金属氧化物还原为金属单质或低价态的氧化物.如:2NH3+3CuO
某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如下图.材料1:NH3是强还原剂,能将某些金属氧化物还原为金属单质或低价态的氧化物.如:2NH3+3CuO
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| 26g |
| 100g |
| A、△H-T△S<0△S<0 |
| B、△H-T△S<0△S>0 |
| C、△H-T△S>0△S>0 |
| D、△H-T△S>0△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
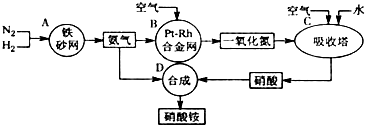
查看答案和解析>>
科目:高中化学 来源: 题型:
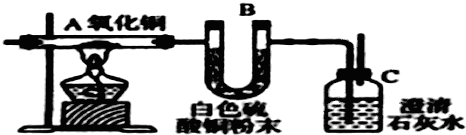
查看答案和解析>>
科目:高中化学 来源: 题型:
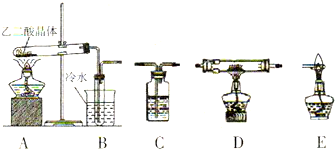
| 装置编号 | 装置中所加物质 | 装置作用 |
| B | -------- | |
| C | ||
| C | 氢氧化钠浓溶液 | |
| C | ||
| D | ||
| E | -------- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸发、蒸馏、萃取 |
| B、萃取、蒸馏、蒸发 |
| C、蒸发、萃取、蒸馏 |
| D、蒸馏、萃取、蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 加入试剂 | 0.1mol/LH2C2O4溶液 | 0.2mol/LH2C2O4溶液 |
| 实验现象 | ||
| 褪色时间 | 16s | 9s |
查看答案和解析>>
科目:高中化学 来源: 题型:
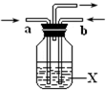 A、B、C、D、E、F、G、H是相对分子质量依次增大的气体,它们均由短周期元素组成,具有如下性质:
A、B、C、D、E、F、G、H是相对分子质量依次增大的气体,它们均由短周期元素组成,具有如下性质:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+ K+ SO42- NO3- |
| B、Mg2+NH4+ SO42- Cl- |
| C、Na+ K+ SO42- NO3- |
| D、K+ Na+ MnO4- SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com