
| A、两途径最终达到平衡时,体系内混合气的平均相对分子质量不同 | ||
| B、两途径最终达到平衡时,体系内混合气的百分组成相同 | ||
| C、达平衡时,途径Ⅰ的反应速率v(A)小于途径Ⅱ的反应速率v(A) | ||
D、达平衡时,途径Ⅰ所得混合气的密度为途径Ⅱ所得混合气密度的
|
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| 盐酸 |
| ① |
| 稀硝酸、盐酸 |
| ② |
| ③ |
| 品 名 | 氯化亚铁 |
| 理化特性 | 白色,遇空气易变成黄色,易吸水,有腐蚀性… |
| 注意事项 | 避免接触空气、碱等;聚乙烯塑料桶包装;避免受热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
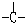 和一个-Cl,它可能的结构有四种,试写出其中的三种结构简式.
和一个-Cl,它可能的结构有四种,试写出其中的三种结构简式.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器中已肯定无Fe粉存在 |
| B、容器中可能有Cu粉存在 |
| C、溶液中Fe2+比Cu2+多 |
| D、溶液中肯定不存在Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Si是一种非金属主族元素,其氧化物可用于制作计算机芯片 |
| B、胃穿孔患者胃酸过多时,可服用含Al(OH)3的药片 |
| C、Mg、Fe等金属在一定条件下与水反应都生成H2和对应的氢氧化物 |
| D、铝粉和氧化镁粉末混合,高温能发生铝热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与酸反应产生的氢气多 |
| B、与碱反应产生的氢气多 |
| C、一样多 |
| D、不知道铝粉的质量,无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、1.4g CO完全燃烧放出热量为28.3kJ |
| B、CO(g)+Na2O2(s)═Na2CO3(s)△H=-509kJ?mol-1 |
| C、2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H<-452kJ?mol-1 |
| D、CO2(g)与Na2O2(s)反应放出226kJ热量时,电子转移为2×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
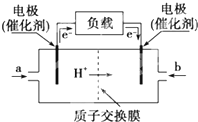 如图是某公司批量生产的笔记本电脑所用的甲醇燃料电池的构造示意图.甲醇在催化剂作用下提供质子(H+)和电子,电子经过电路、质子经内电路到达另一极与氧气反应,该电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列有关该电池的说法错误的是( )
如图是某公司批量生产的笔记本电脑所用的甲醇燃料电池的构造示意图.甲醇在催化剂作用下提供质子(H+)和电子,电子经过电路、质子经内电路到达另一极与氧气反应,该电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列有关该电池的说法错误的是( )| A、右边的电极为电池的负极,b处通入的是空气 |
| B、左边的电极为电池的负极,a处通入的是甲醇 |
| C、电池负极的反应式为:2CH3OH+2H2O-12e-═2CO2↑+12H+ |
| D、电池正极的反应式为:3O2+12H++12e-═6H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com