
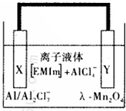
 铝是一种高能量载体,是开发电池的理想电极材料.如图所示的室温铝二次电池,采用有机阳离子(EMlm)和 AlCl4-组成的离子液体为电解液,有关反应为Al+Mn2O4$?_{充电}^{放电}$AlMn2O4 下列说法正确的是( )
铝是一种高能量载体,是开发电池的理想电极材料.如图所示的室温铝二次电池,采用有机阳离子(EMlm)和 AlCl4-组成的离子液体为电解液,有关反应为Al+Mn2O4$?_{充电}^{放电}$AlMn2O4 下列说法正确的是( )| A. | 电池放电时,Ac-4-向Y极扩散 | |
| B. | 电池放电时,X是正极 | |
| C. | 电池充电时X极的反应为:4Al2Cl7-+3e-=Al+7AlCl4- | |
| D. | 铝作为负极材料的比能量高于锂 |
分析 据电池反应Al+Mn2O4$?_{充电}^{放电}$AlMn2O4 分析,Al失电子发生氧化反应,X为Al,是负极,Y是正极,A、原电池中阴离子移向负极;
B、放电时X为负极,充电时X为阴极;
C、充电时X为阴极,电极反应式为:4Al2Cl7-+3e-=Al+7Cl4-;
D、Li相对原子质量小.
解答 解:据电池反应Al+Mn2O4$?_{充电}^{放电}$AlMn2O4 分析,Al失电子发生氧化反应,X为Al,是负极,Y是正极,
A、Y为正极,阴离子移向负极,故A错误;
B、据图象分析,X为Al,是负极,故B错误;
C、充电时X为阴极,电极反应式为:4Al2Cl7-+3e-=Al+7AlCl4-,故C正确;
D、Li是最轻的金属,Li的比能量高于Al,故D错误;
故选C.
点评 本题考查了二次电池的反应原理,负极发生氧化反应,正极发生还原反应,题目难度较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
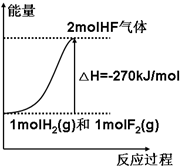 已知:H2(g)+F2(g)=2HF(g)△H=-270kJ/mol[表示1mol H2(g)与1mol F2(g)化合生成2mol HF(g)放出270kJ热量],下列说法正确的是( )
已知:H2(g)+F2(g)=2HF(g)△H=-270kJ/mol[表示1mol H2(g)与1mol F2(g)化合生成2mol HF(g)放出270kJ热量],下列说法正确的是( )| A. | 该反应的逆反应是放热反应 | |
| B. | 该反应过程的能量变化可用右图来表示 | |
| C. | 1 mol H2(g)与1 mol F2(g)反应生成2 mol液态HF放出的热量小于270 kJ | |
| D. | 在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和大于2 mol HF(g)的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .醇酸树脂是一种成膜性良好的树脂,下面是一种醇酸树脂的合成线路:
.醇酸树脂是一种成膜性良好的树脂,下面是一种醇酸树脂的合成线路: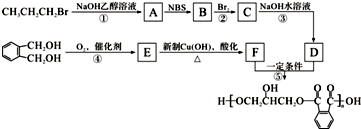
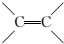 ,C的名称是1,2,3-三溴丙烷.
,C的名称是1,2,3-三溴丙烷.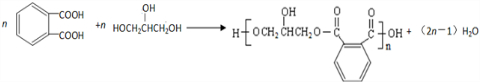 .
.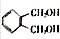 的同分异构体中同时符合下列条件的芳香族化合物共有6种.
的同分异构体中同时符合下列条件的芳香族化合物共有6种.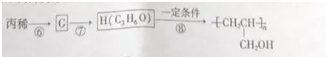
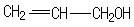 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2与D2 | B. | T2O与H2O | ||
| C. | ${\;}_{19}^{40}$K与${\;}_{19}^{39}$K | D. | 金刚石与石墨 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
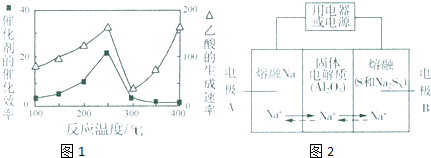
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16O与18O互为同位素;H2${\;}_{\;}^{16}$O、D2${\;}_{\;}^{16}$O、H2${\;}_{\;}^{18}$O、D2${\;}_{\;}^{18}$O互为同素异形体 | |
| B. | SiH4、PH3、HCl的稳定性逐渐增强 | |
| C. | 氧化铁的化学式:FeO | |
| D. | Ca2+的结构示意图为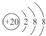 ,NH4Cl的电子式为 ,NH4Cl的电子式为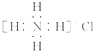 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤经分馏得到了煤焦油,从中可分离出苯、甲苯、二甲苯等有机化合物 | |
| B. | 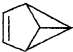 的一氯代物有3种 的一氯代物有3种 | |
| C. | 若两种二肽互为同分异构体,则二者的水解产物一定不相同 | |
| D. | 木糖醇(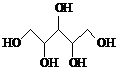 )和葡萄糖( )和葡萄糖(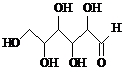 ),互为同系物,均属于糖类 ),互为同系物,均属于糖类 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com