
| ||
| 1.12L |
| 22.4L/mol |
|
| 14g/mol×0.06mol |
| 3.44g |


科目:高中化学 来源: 题型:
| 序号 | 实验内容 | 实验目的 |
| A | 室温下用PH计测定浓度为0.1mol?L-1NaClO溶液和0.1mol?L-1 CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
| C | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
| D | 向NaAlO2溶液中滴加饱和NaHCO3溶液,有白色沉淀产生 | 验证两者都发生了水解反应,且相互促进 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
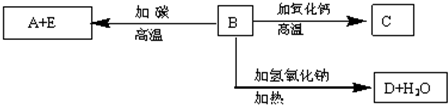
查看答案和解析>>
科目:高中化学 来源: 题型:
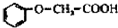 )发生化
)发生化查看答案和解析>>
科目:高中化学 来源: 题型:
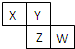 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )| A、气态氢化物的稳定性:Y>X |
| B、原子半径:W>Z>Y>X |
| C、X、Z、W的气态氢化物溶于水均呈酸性 |
| D、最高价氧化物对应水化物的酸性:Z>W>X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com