
【题目】硼(B)可形成H3BO3、NaBH4、NaBO2等化合物,用途广泛。
(1)H3BO3为一元弱酸,常温下,在水中存在如下电离平衡:H3BO3 + H2O![]() [B(OH)4]-+H+,Ka=5.72×10-10。
[B(OH)4]-+H+,Ka=5.72×10-10。
①25℃时,0.175 mol/L的H3BO3溶液pH约为_________。
②已知碳酸H2CO3的电离平衡常数为Ka1 = 4.4×10-7,Ka2 = 4.7×10-11。将少量碳酸钠溶液滴加到饱和硼酸溶液中,反应的离子方程式为_________。
(2)在容积恒定为2 L的密闭容器中加入足量BPO4和Na固体并充入一定量的H2(g)发生储氢反应:BPO4(s)+4Na(s)+2H2(g)![]() Na3PO4(s)+NaBH4(s) △H<0
Na3PO4(s)+NaBH4(s) △H<0
①体系中H2的物质的量与反应时间的关系如表所示:
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
n(H2)/mol | 2.0 | 1.5 | 1.2 | 0.9 | 0.8 | 0.8 |
下列有关叙述正确的是(填标号)_________。
a. 当容器内气体的摩尔质量不再变化时,反应达到平衡状态
b. 10 min时向容器内通入少量H2,则重新达平衡前ν(放氢)> ν(吸氢)
c. 保持温度不变,平衡后再充入1 mol H2,达新平衡时H2的浓度为0.4 mol/L
d. 升高温度,放氢速率加快,重新达到平衡时容器压强增大
②图为产率与反应温度的关系曲线,NaBH4的产率在603K之前随温度升高而增大,在603K之后随温度升高而减小的原因是_________。

(3)NaBH4(s)遇H2O(l)剧烈水解,生成氢气和NaBO2(s)。

①通常状况下,实验测得3.8 g NaBH4(s)发生水解反应放出21.6 kJ热量,写出该反应的热化学方程式_________。
②![]() 为NaBH4水解的半衰期(水解一半所需要的时间,单位为min)。lg
为NaBH4水解的半衰期(水解一半所需要的时间,单位为min)。lg![]() 随pH和温度的变化如图所示。溶液pH=4时,NaBH4_________(填“能”或“不能”)稳定存在,原因是_________(用离子方程式表示);T1_________T2。(填 “>”或“<”)
随pH和温度的变化如图所示。溶液pH=4时,NaBH4_________(填“能”或“不能”)稳定存在,原因是_________(用离子方程式表示);T1_________T2。(填 “>”或“<”)
③硼氢化钠具有极强还原性,碱性条件可用于处理电镀废液中的CuSO4制得纳米铜,从而变废为宝。写出电镀阳极反应方程式_______________。
【答案】5 CO32-+H2O+H3BO3=HCO3-+[B(OH)4]- cd 603K之前,反应未达到平衡状态,温度升高,反应速率加快;603K之后达到平衡,随温度升高,平衡逆向移动 NaBH4(s)+2H2O(l)=NaBO2(s)+4H2(g) △H= -216kJ/mol 不能 BH4-+H++3H2O=H3BO3+4H2↑ < BH4- -8e-+8OH-=BO2-+6H2O
【解析】
(1)①利用电离常数表达式先计算出c(H+),再根据pH=-lgc(H+);
②根据电离平衡常数越大,溶液的酸性越强。强酸与弱酸的盐反应制取弱酸书写;
(2)①a.体系中只有H2一种气体,摩尔质量固定不变;
b.根据物质浓度对化学平衡移动移动分析;
c.根据化学平衡常数只与温度有关判断;
d.根据温度对化学反应速率和压强的影响分析;
②根据温度对化学反应速率和化学平衡移动的影响分析原因;
(3)①先书写反应方程式,然后根据物质变化与能量变化成正比,得到其相应的热化学方程式;
②NaBH4和酸反应生成硼酸和氢气;水解反应为吸热反应,升温促进水解正向进行;
③硼氢化钠具有极强还原性,电镀时BH4-在阳极失去电子,发生氧化反应。
(1)①根据电离平衡H3BO3 + H2O![]() [B(OH)4]-+H+可知Ka=
[B(OH)4]-+H+可知Ka=![]() =5.72×10-10,由于c(H3BO3)=0.175mol/L,所以c2(H+)=1×10-10,所以c(H+)=1×10-5mol/L,溶液的pH=5;
=5.72×10-10,由于c(H3BO3)=0.175mol/L,所以c2(H+)=1×10-10,所以c(H+)=1×10-5mol/L,溶液的pH=5;
②由于H3BO3的电离平衡常数是5.72×10-10,二元弱酸H2CO3的电离平衡常数Ka1 = 4.4×10-7,Ka2 = 4.7×10-11,所以酸性:H2CO3> H3BO3>HCO3-。将少量碳酸钠溶液滴加到饱和硼酸溶液中,反应的离子方程式为CO32-+H2O+H3BO3=HCO3-+[B(OH)4]-;
(2)①a.根据反应方程式可知:体系中只有H2一种气体,所以无论是否达到平衡状态,体系的摩尔质量都不变,因此不能据此判断反应是否处于平衡状态,a错误;
b.由表中数据可知,该反应在10 min时已达平衡,在其它条件不变时,通入氢气,使反应物浓度增大,化学平衡正向移动,重新达平衡前ν(吸氢) >ν(放氢),b错误;
c.该反应的化学平衡常数K=![]() ,温度不变,化学平衡常数不变,所以保持温度不变,平衡后再充入1 mol H2,达新平衡时H2的浓度仍为0.4 mol/L,c正确;
,温度不变,化学平衡常数不变,所以保持温度不变,平衡后再充入1 mol H2,达新平衡时H2的浓度仍为0.4 mol/L,c正确;
d.由于该反应为放热反应,在其它条件不变时,升高温度,化学反应速率加快,平衡向逆反应方向移动,氢气的物质的量增大,体系的压强增大,d正确;
故合理选项是cd;
②在603K之前,反应正向进行,反应未达到平衡状态,温度升高,反应速率加快,更多的反应物转化为生成物,反应物的转化率增大;603K之后达到平衡,由于该反应的正反应是放热反应,随着温度的升高,化学平衡向吸热的逆反应移动,导致反应物的转化率降低;
(3)①n(NaBH4)=3.8g÷38g/mol=0.1mol,反应放出热量是21.6 kJ,则1mol固态NaBH4与水反应产生固态NaBO2和氢气,放出热量是216kJ,故其热化学方程式为:NaBH4(s)+2H2O(l)=NaBO2(s)+4H2(g) △H= -216kJ/mol;
②NaBH4可水解放出氢气,反应方程式为:NaBH4+2H2O═NaBO2+4H2↑,在酸性条件下,NaBH4不能稳定性存在,NaBH4和酸反应生成硼酸和氢气,反应的离子方程式为:BH4-+H++3H2O=H3BO3+4H2↑,温度越高化学反应速率越大,半衰期越短,所以T1<T2;
③硼氢化钠具有极强还原性,碱性条件可用于处理电镀废液中的CuSO4制得纳米铜,从而变废为宝。电镀时BH4-在阳极失去电子,发生氧化反应,阳极反应式为:BH4- -8e-+8OH-=BO2-+6H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)已知室温下CO的燃烧热为283 kJ/mo1,则CO的燃烧热的热化学方程式为___________________________________。
(2)工业上利用CO和H2合成清洁能源CH3OH,其反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH=-116kJ/mo1
CH3OH(g) ΔH=-116kJ/mo1
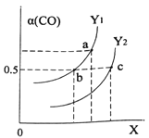
如图表示CO的平衡转化率(α)随温度和压强变化的示意图。X表示的是_____________,Y1_____Y2(填“<”、“=”、“>”)。
(3)合成甲醇的反应原理为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),在1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),在1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。

①反应进行到4min时,v(正)____v(逆)(填“>”“<”或“=”)。0~4min,CO2的平均反应速率v(CO2)=____________mol·L1·min1。
②该温度下平衡常数为_____________。
③下列能说明该反应已达到平衡状态的是______________。
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1∶3∶1∶1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
(4)为提高燃料的能量利用率,常将其设计为燃料电池。某电池以甲烷为燃料,空气为氧化剂,KOH溶液为电解质溶液,以具有催化作用和导电性能的稀土金属为电极。写出该燃料电池的负极反应式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。
该组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:
2MnO![]() +5H2C2O4+6H+===2Mn2++10CO2↑+8H2O
+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O
学习小组的同学设计了如下步骤用滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000 mol·L-1的酸性KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL。
(1)上述步骤②中使用的锥形瓶是否需要事先用待测液润洗_______。(填“是”或“否”)滴定时,将酸性KMnO4标准液装在如图中的________(填“甲”或“乙”)滴定管中。

(2)本实验滴定达到终点的标志可以是________________________________。
(3)通过上述数据,求得x=________。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会________(填“偏大”、“偏小”或“不变”,下同)。
②根据上述实验计算的数据可信性不强,为了提高实验的准确性,请写出改进方法______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中氟多以化合态形式存在,主要有萤石(CaF2)、冰晶石(Na3AlF6)等
(1)基态氟原子中,有_______种能量不同的电子。
(2)萤石(CaF2)难溶于水,但可溶于含Al3+的溶液中,原因是_________________(用离子方程式表示)。(已知AlF63-在溶液中可稳定存在)
(3)BF3与一定量的水形成(H2O)2BF3晶体Q,晶体Q在一定条件下可转化为R:

①晶体R中含有的化学键包括_________(填标号)。
A.离子键 B.配位键 C.共价键 D.氢键
②R中阳离子的空间构型为_________,阴离子中心原子的杂化方式为_________。
(4)F2与其他卤素单质反应可以形成卤素互化物,如ClF3、BrF3等。ClF3的熔沸点比BrF3的低,原因是___________________________________。
(5)Na3AlF6晶胞结构如图所示:

①位于大立方体体心▽代表________(填离子符号);
②AlF63-做面心立方最密堆积形成正四面体和正八面体两种空隙,正四面体空隙数和AlF63-数之比为_______,其中_________%正八面体空隙被Na+填充;
③晶胞边长为x nm,则相距最近的两个Na+之间距离为_____ nm;设Na3AlF6的相对分子质量为M,阿伏加德罗常数为NA,则该晶体密度的计算表达式为________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有浓度均为0.5mol/L的四种溶液:①Na2CO3、②NaHCO3、③HCl、④NH3·H2O.
(1)上述溶液中,可发生水解的是________(填序号,下同).
(2)向④中加入少量氯化铵固体,此时![]() 的值________(填“增大”、“减小”或“不变”).
的值________(填“增大”、“减小”或“不变”).
(3)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积________④的体积(填“大于”、“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是__________________________.
(4)取10mL溶液③,加水稀释到500mL,则此时溶液中由水电离出的c(H+)=________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置,C、D、E、F、X、Y都是惰性电极。A、B为电源,将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则以下说法正确的是

A. 电源B极是正极
B. 欲用丙装置给铜镀银,H应该是Cu,电镀液是AgNO3溶液
C. 甲、乙装置的C、E电极均有单质生成,其物质的量之比为1:1
D. 装置丁电解一段时间后溶液的pH不变。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOH ![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中,在金属元素和非金属元素分界线附近能找到( )
A. 制半导体的元素B. 制催化剂的元素
C. 制农药的元素D. 制耐高温合金的元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com