
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/LNaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A.V(NaOH)=0时,c(H+)=1×10-2mol/L
B.V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4- )
C.V(NaOH)=10 mL时,c(H+)=1×10-7mol/L
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4- )
D
【解析】
试题分析:A、草酸是二元中强酸,V(NaOH)=0时,NaHC2O4不能完全电离出H+,则c(H+)<1×10-2mol?L-1,故A错误;B、V(NaOH)<10mL时,溶液中溶质为NaHC2O4、Na2C2O4,当电离程度等于水解程度,即c(H+)=c(OH-),存在c(Na+)=2c(C2O42-)+c(HC2O4- ),故B不正确;C、V(NaOH)=10 mL时,溶液中溶质为Na2C2O4,溶液显碱性,则c(H+)<1×10-7mol?L-1,故C错误;D、V(NaOH)>10 mL时,溶液中溶质为NaOH、Na2C2O4,C2O42-水解生成HC2O4-,则离子浓度为c(Na+)>c(C2O42-)>c(HC2O4- ),故D正确;故选D。
考点:考查盐类水解、电离平衡以及溶液中离子浓度大小比较


科目:高中化学 来源:2013-2014天津市第二学期期中检测高一化学试卷(解析版) 题型:选择题
固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是
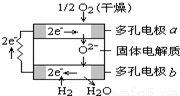
A.有O2放电的a极为电池的负极
B.a极对应的电极反应为:O2+ 2H2O+ 4e--= 4OH-
C.有H2放电的一极电极反应为:H2+O2- -2 e- =H2O
D.该电池的总反应方程式为:2H2+ O2= 2H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市下学期期中考试高二化学试卷(解析版) 题型:选择题
下列反应无论怎样调整反应物的用量都只能生成一种物质的是
A.甲烷和氯气混合后光照发生反应 B.乙烯与氯化氢的加成反应
C.1,3—丁二烯与氢气发生反应 D.乙炔和氯气的加成反应
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市南开区高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
(14分)已知X、Y、Z、M、G、Q是六种短周期元素,原子序数依次增大。X、Z、Q的单质在常温下呈气态;Y的原子最外层电子数是其电子层数的2倍;X与M同主族;Z、G分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)Y、Z、M、G四种元素原子半径由大到小的顺序是(写元素符号) 。
(2)Z在元素周期表中的位置为 。
(3)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式) 。
(4)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式) ,在实验室中,制取该物质的反应原理是(写化学方程式) 。
(5)M2Z的电子式为 。MX与水反应可放出气体,该反应的化学方程式为 。
(6)常温下,不能与G的单质发生反应的是(填序号) 。
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
工业上用电解法制G的单质的化学方程式是 ,若以石墨为电极,阳极产生的混合气体的成分是(写化学式) 。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市南开区高三二模试卷理综化学试卷(解析版) 题型:简答题
(14分)化学在能源开发与利用中起着十分重要的作用。
(1)蕴藏在海底的可燃冰是高压下形成的外观像冰的甲烷水合物固体.被称之为“未来能源”。在25℃、101 kPa下,1g甲烷完全燃烧生成和液态水时放热55.6 kJ。甲烷燃烧的热化学方程式为 ______:相同条件下,356 g可燃冰(分子式为CH4·9H2O,Mr=178)释放的甲烷气体完全燃烧生成CO2和液态水,放出的热量为_______kJ。
(2)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,具有清洁、高效的优良性能。由合成气(组成为H2、CO和少量的CO2)直接制各二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(Ⅰ)CO(g)+2H2(g)═CH3OH(g) △H1=-90.1kJ?mol-1
(Ⅱ)CO2(g)+3H2(g)═CH3OH(g)+H2O(g) △H2=-49.0kJ?mol-1
水煤气变换反应:(Ⅲ)CO(g)+H2O(g)═CO2(g)+H2 (g) △H3=-41.1kJ?mol-1
二甲醚合成反应:(Ⅳ)2CH3OH(g)═CH3OCH3(g)+H2O(g)△H4=-24.5kJ?mol-1
①分析二甲醚合成反应(iv)对于CO转化率的影响___________________________________。
②由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为:__________________。根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响_________________________________。
(3)二甲醚直接燃料电池具有启动快、效率高等优点。若电解质为碱性,二甲醚直接燃料电池的负极反应为______________________,一个二甲醚分子经过电化学氧化,可以产生________电子的电量。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高三毕业班联考二理综化学试卷(解析版) 题型:选择题
(14分)“氢能”将是未来最理想的新能源。
Ⅰ 在25℃,101KPa条件下,1 g氢气完全燃烧生成液态水时放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为 。
Ⅱ 氢气通常用生产水煤气的方法制得。其中CO(g)+ H2O(g) CO2(g)+H2(g) △H<0。在850℃时,平衡常数K=1。
CO2(g)+H2(g) △H<0。在850℃时,平衡常数K=1。
(1)若升高温度至950℃,达到新平衡状态时K (填“>”、“<”或“=”)1。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 molCO、3.0mol H2O、1.0 molCO2和x mol H2,则:
①当x = 5.0时,上述平衡向 (填“正反应”或“逆反应”)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
③若设x=5.0 mol和x=6.0 mol,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a (填“>”、“<”或“=”)b。
Ⅲ 海水淡化获得淡水的过程也可以产生氢气。下面是利用电渗析法处理海水获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题:
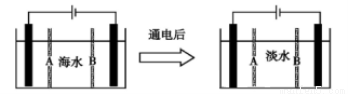
(1)阳离子交换膜是指______________ (填A或B)。
(2)写出通电后阳极的电极反应式:_________________________________________,在阴极区观察到的现象是:_________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高三毕业班联考二理综化学试卷(解析版) 题型:选择题
NA为阿伏加德罗常数的值。下列叙述正确的是
A.1.0 L 1.0 mol·L-1的NaClO水溶液中含有的氧原子数为NA
B.25 ℃时1L pH=13的Ba(OH)2溶液中含有OH-的数目为0.1NA
C.2.24 L 的2H35Cl分子中的中子数是1.9NA
D.某密闭容器中盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,形成N—H键的数目为0.6NA
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市东丽区第一学期期末质量监测高一年级化学试卷(解析版) 题型:选择题
下列化学方程式中,不能用H++OH-=H2O表示的是
A.KOH+HCl=KCl+H2O B.2NaOH+H2SO4=Na2SO4+2H2O
C.Ba(OH)2+2HCl=BaCl2+2H2O D.Cu(OH)2+2HNO3=Cu(NO3)2+2H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014天津五区县高一下学期期末考试化学试卷(解析版) 题型:选择题
某同学做完铜、锌稀硫酸原电池的实验后得出了下列结论,你认为正确的是
A.构成原电池正极和负极的材料必须是两种金属
B.当由铜、锌电极与硫酸铜溶液组成原电池时,铜是负极
C.该实验电子沿导线由锌流向铜,氢离子得到电子而放出氢气
D.铜锌原电池工作时,电流由锌经导线流向铜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com