
| A. | 乙酸的分子式:C2H4O | B. | 苯的结构简式: | ||
| C. | H2O2的电子式: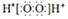 | D. | 乙醛分子的结构简式:CH3COH |
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
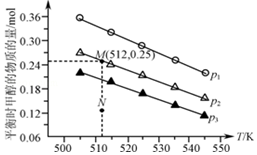 在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法正确的是( )
在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法正确的是( )| A. | 该反应的正反应为吸热反应 | |
| B. | 压强大小关系为p1<p2<p3 | |
| C. | M点对应的平衡常数K的值约为1.04×10-2 | |
| D. | 在p2及512 K时,图中N点 v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
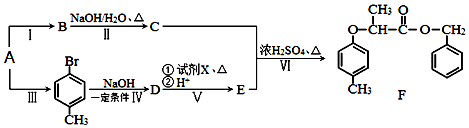
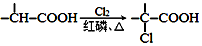
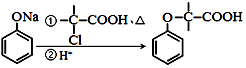
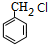 +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$ +NaCl.
+NaCl.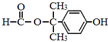 .
.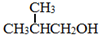 为原料制取
为原料制取 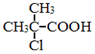 的合成路线图.合成路线图示例如下:
的合成路线图.合成路线图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na和O2 | B. | Fe和FeCl3 | C. | Fe和H2SO4 | D. | AlCl3和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
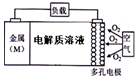 电池的“理论比能量”指单位质量的电极材料理论上能释放的最大电能.“金属(M)〜空气电池”(如图)具有原料易得、能量密度高等优点.该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n.下列说法不正确的是( )
电池的“理论比能量”指单位质量的电极材料理论上能释放的最大电能.“金属(M)〜空气电池”(如图)具有原料易得、能量密度高等优点.该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n.下列说法不正确的是( )| A. | “金属(M)〜空气电池”放电过程的正极反应式:O2+2H2O+4e-=4OH- | |
| B. | 电解质溶液中的阴离子从负极区移向正极区 | |
| C. | 比较Mg、Al、Zn三种“金属-空气电池”,“Al-空气电池”的理论比能量最高 | |
| D. | 在“M-空气电池”中,标准状况下消耗22.4L氧气,则电路中转移电子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com