
【题目】体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是
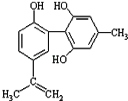
A.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
B.滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
C.该分子中的所有碳原子不可能共平面
D.1mol此物质分别与浓溴水和H2反应时最多消耗Br2和H2为4mol和7mol
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列实验不能达到实验目的的是
|
|
A、研究浓度对反应速率的影响 | B、研究阳离子对 |
|
|
C、研究沉淀的转化 | D、研究酸碱性对平衡移动的影响 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的有( )
①需要通电才可以进行的有:电解、电离、电镀、电泳②水玻璃、福尔马林、天然橡胶、铝热剂都是混合物③![]() 、
、![]() 、
、![]() 均可由化合反应制得④油脂、淀粉、纤维素、天然橡胶都是天然有机高分子化合物⑤“血液透析”和“静电除尘”利用了胶体的同一种性质⑥
均可由化合反应制得④油脂、淀粉、纤维素、天然橡胶都是天然有机高分子化合物⑤“血液透析”和“静电除尘”利用了胶体的同一种性质⑥![]() 、
、![]() 分子中的碳原子均共面⑦铅蓄电池放电结束后,正极电极板的质量在减小
分子中的碳原子均共面⑦铅蓄电池放电结束后,正极电极板的质量在减小
A. 2个B. 3个C. 4个D. 5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:已知亚磷酸![]() 是具有强还原性的二元弱酸,可被银离子氧化为磷酸。
是具有强还原性的二元弱酸,可被银离子氧化为磷酸。
(1)亚磷酸与银离子反应的离子方程式为_______________________。
(2)向亚磷酸溶液中滴加氢氧化钠溶液至中性,写出所得溶液中电荷守恒方程式_________________。
(3)某温度下,![]() 的亚磷酸溶液的pH为1.4,即
的亚磷酸溶液的pH为1.4,即![]() ,则该温度下亚磷酸的一级电离平衡常数
,则该温度下亚磷酸的一级电离平衡常数![]() _________。(亚磷酸第二级电离忽略不计,结果保留两位有效数字)
_________。(亚磷酸第二级电离忽略不计,结果保留两位有效数字)
Ⅱ:焦亚硫酸钠![]() 在医药、印染、食品等方面应用广泛,也可作为食品的抗氧化剂。
在医药、印染、食品等方面应用广泛,也可作为食品的抗氧化剂。
(4)工业上制备焦亚硫酸钠![]() 常用
常用![]() 与碳酸钠溶液的反应,当
与碳酸钠溶液的反应,当![]() 加过量直至过饱和时,溶液中就会析出焦亚硫酸钠的晶体,写出该反应的化学方程式:__________________________。
加过量直至过饱和时,溶液中就会析出焦亚硫酸钠的晶体,写出该反应的化学方程式:__________________________。
(5)由于![]() 具有毒性,因此国家对其在食品中的用量有严格的规定。某化学兴趣小组在测定某白葡萄酒中
具有毒性,因此国家对其在食品中的用量有严格的规定。某化学兴趣小组在测定某白葡萄酒中![]() 的残留量时,取40mL葡萄酒样品,用
的残留量时,取40mL葡萄酒样品,用![]() 的含有淀粉的碘的标准溶液滴定至终点,消耗碘标准溶液5mL,则滴定终点的现象为_________________,该样品中
的含有淀粉的碘的标准溶液滴定至终点,消耗碘标准溶液5mL,则滴定终点的现象为_________________,该样品中![]() 的残留量为___________
的残留量为___________ ![]() (以
(以![]() 计)。
计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 在NH![]() 和[Cu(NH3)4]2+中都存在配位键
和[Cu(NH3)4]2+中都存在配位键
B. 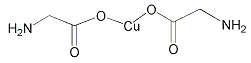 σ键和π键比例为7:1
σ键和π键比例为7:1
C. C![]() 与O
与O![]() 互为等电子体,1 mol O
互为等电子体,1 mol O![]() 中含有的π键数目为2NA
中含有的π键数目为2NA
D. 已知反应N2O4(l)+2N2H4(l)===3N2(g)+4H2O(l),若该反应中有4 mol N—H键断裂,则形成的π键数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 与
与![]() 反应制备KI固体,装置如图所示。实验步骤:①检查装置的气密性;②关闭K,在各装置中加入相应试剂,向装置B中滴入30%的KOH溶液,制得
反应制备KI固体,装置如图所示。实验步骤:①检查装置的气密性;②关闭K,在各装置中加入相应试剂,向装置B中滴入30%的KOH溶液,制得![]() ;③打开K,通入
;③打开K,通入![]() 直至饱和可制得KI,同时有黄色沉淀生成;④关闭K,向所得溶液滴入稀硫酸,水浴加热,充分逸出
直至饱和可制得KI,同时有黄色沉淀生成;④关闭K,向所得溶液滴入稀硫酸,水浴加热,充分逸出![]() ;⑤把装置B中混合液倒入烧杯,为除去硫酸,加入足量碳酸钡,再经过一系列操作可得成品。下列有关该实验的叙述错误的是( )
;⑤把装置B中混合液倒入烧杯,为除去硫酸,加入足量碳酸钡,再经过一系列操作可得成品。下列有关该实验的叙述错误的是( )
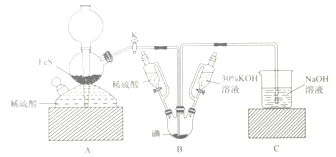
A. 步骤②可观察到固体溶解,溶液由棕黄色变为无色
B. 步骤③装置B中发生反应的离子方程式为![]()
C. 装置C中氢氧化钠溶液的作用是吸收硫化氢
D. 步骤⑤中一系列操作为过滤,洗涤,合并滤液和洗液,蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2017年中科院某研究团队通过设计一种新型Na-Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
已知:H2(g)+1/2O2(g)=H2O(l) ΔH1 = -aKJ/mol
C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH2= -bKJ/mol
试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式_________________________________。
(2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有:
甲:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
乙:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
①CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应△H_____0(填“大于”或“小于”)。
CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应△H_____0(填“大于”或“小于”)。
②提高CO2转化为CH3OH平衡转化率的措施有___________(填写两项)。
③催化剂和反应体系的关系就像锁和钥匙的关系一样,具有高度的选择性。下列四组实验,控制CO2和H2初始投料比均为1:2.2,经过相同反应时间(t1min)。
温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) | 综合选项 |
543 | Cu/ZnO纳米棒材料 | 12.3 | 42.3 | A |
543 | Cu/ZnO纳米片材料 | 11.9 | 72.7 | B |
553 | Cu/ZnO纳米棒材料 | 15.3 | 39.1 | C |
553 | Cu/ZnO纳米片材料 | 12.0 | 70.6 | D |
由表格中的数据可知,相同温度下不同的催化剂对CO2的转化为CH3OH的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为___________(填字母符号)。
(3)以CO、H2为原料合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
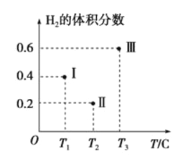
①0~5min时间内容器Ⅱ中用CH3OH表示的化学反应速率为_________________。
②三个容器中一定达到平衡状态的是容器________(填写容器代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)![]() 2SO3(g)△H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
2SO3(g)△H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
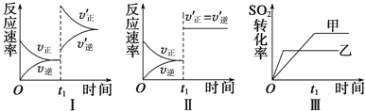
A. 图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
B. 图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
C. 图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.根据化合物在水溶液或熔融状态下是否导电,将化合物分为电解质和非电解质
B.氨气的水溶液能够导电,因此NH3是电解质
C.电解质溶液的导电能力与溶液中离子浓度及离子所带电荷多少有关
D.溶液与胶体的本质区别是分散质颗粒直径大小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com