
| A. | 达到平衡后再充入少量X气体,上述反应的△H增大 | |
| B. | 达到平衡时,反应速率v正(X)=2v逆(Z) | |
| C. | 达到平衡后,降低温度,正向反应速率大于逆向反应速率 | |
| D. | 达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动 |
分析 A.△H与反应方程式有关,与参加反应的反应物多少无关;
B.平衡时不同物质的量正逆反应速率之比等于化学计量数之比;
C.该反应为放热反应,降低温度,平衡正向移动;
D.该反应为气体体积不变,放热的反应.
解答 解:A.达到平衡后再充入少量X气体,平衡正向移动,但上述反应的△H不变,故A错误;
B.达到平衡时,反应速率2v正(X)=v逆(Z),故B错误;
C.该反应为放热反应,降低温度,平衡正向移动,则正向反应速率大于逆向反应速率,故C正确;
D.达到平衡后,升高温度该反应平衡向逆反应方向移动,而增大压强平衡不移动,故D错误;
故选C.
点评 本题考查化学平衡移动,为高频考点,把握温度、压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意焓变判断及W为固体,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 钌催化剂能加快该反应的速率 | B. | 升高温度能减慢该反应的速率 | ||
| C. | 达到平衡时,CO2能100%转化为CH4 | D. | 达到平衡时,反应速率:v(正)=v(逆)=0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” | |
| B. | 我国发射的“嫦娥三号”卫星中使用的碳纤维,是一种新型无机非金属材料 | |
| C. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,是发生雾霾天气的主要原因,这些颗粒物扩散在空气中都会形成胶体 | |
| D. | 双氧水、高锰酸钾溶液可以完全杀死埃博拉病毒,其消毒原理与漂白粉消毒饮用水的原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1 的KI溶液中:MnO4-、Na+、Cl-、OH- | |
| B. | 0.1mol•L-1 的NH3•H2O 溶液中Fe3+、Na+、SO42-、ClO- | |
| C. | 遇石蕊试液变红的溶液中:Na+、Mg2+、Cl-、SO42- | |
| D. | 遇酚酞变红的溶液中:K+、S2O32-、NO3-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量相等的O2和O3 | B. | 原子数目相等的CO和N2 | ||
| C. | 电子数目相等的O2和N2 | D. | 等压、等体积的N2和CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2的质量只有在标准状况下才约为2 g | |
| B. | 在标准状况下,22.4 L由N2、N2O组成的混合气体中所含有的氮原子的物质的量约为2 mol | |
| C. | 在20℃时,1 mol任何气体的体积总比22.4 L大 | |
| D. | 1 mol H2和O2的混合气体,在标准状况下的体积大于22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的CO2通入Ca(ClO)2溶液中 2ClO-+CO2+H2O═CO32-+2HClO | |
| B. | AgNO3溶液滴入少量的Na2S溶液 2Ag++S2-═Ag2S↓ | |
| C. | 向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+═CO2↑+H2O | |
| D. | 向Ba(OH)2溶液中加入少量的NaHSO3溶液2HSO3-+Ba2++2OH-═BaSO3↓+SO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 共价键 | C-C | C═C | C-H | H-H |
| 键能/(kJ•mol-1) | 348 | 610 | 413 | 436 |
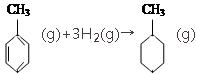 的焓变
的焓变| A. | ①②③④ | B. | ③④⑤ | C. | ④⑤ | D. | ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
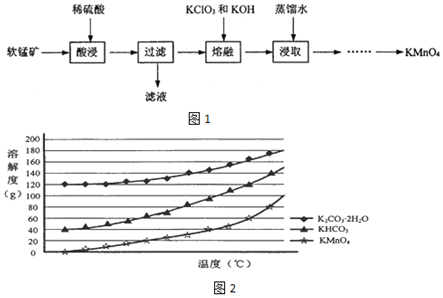
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com