
����Ŀ��ijС��ͬѧ��FeCl3��KI�ķ�Ӧ����̽����
������̽���������½����±�����ʵ�顣
��� | ���� | ���� |
ʵ��� | ȡ5 mL 0.1 mol��L-1 KI��Һ���μ�0.1 mol��L-1FeCl3��Һ5��6��(�����ҺpH=5) | ��Һ��Ϊ�ػ�ɫ |
ʵ��� | ȡ2 mLʵ���Ӧ�����Һ���μ�2��0.1 mol��L-1 KSCN��Һ | ��Һ�ʺ�ɫ |
��1��֤��ʵ�������I2���ɣ�������Լ�Ϊ __________��
��2��д��ʵ���Ӧ�����ӷ���ʽ��_________________��
��3���������ʵ���������֤��Fe3+��I-�������淴Ӧ��ԭ����_____________________��
������̽����20 min������۲�ʵ������ʵ�����Һ�ػ�ɫ���ʵ�����Һ��ɫ��dz��
��4����֪�����Խ�ǿ�������£�I-�ɱ���������ΪI2���ʼ�ͬѧ������裺�÷�Ӧ�����¿�����I-����ΪI2��ʹʵ�������Һ�ػ�ɫ�����ͬѧ���ʵ�飺________��20 min����Һ��������֤���ü��費������������Һ������������������_____________(д������)��
��5����ͬѧ�������Ͽ�֪��FeCl3��KI�ķ�Ӧ��ϵ�л�����I- + I2![]() I3-��I3-���غ�ɫ���������ϴ�ƽ���ƶ�ԭ������ʵ�����20 min����Һ��ɫ��dz��ԭ��____________��
I3-��I3-���غ�ɫ���������ϴ�ƽ���ƶ�ԭ������ʵ�����20 min����Һ��ɫ��dz��ԭ��____________��
��6����ͬѧ���20 min���ʵ���������������裺FeCl3��KI�ķ�Ӧ��I-��I2�ķ�Ӧ�ﵽƽ����Ҫһ��ʱ�䣬�п���20 min֮ǰ��δ�ﵽƽ�⡣Ϊ��֤�ü��裬��ͬѧ��4֧�Թܽ���ʵ�飬�õ�����ɫ��dz������ĸ���ɫ��Һ��ϵ������ʵ�鷽��Ϊ__________________��
���𰸡�������Һ��CCl4 2Fe3++2I-![]() 2Fe2++I2 ʵ���ͨ������KI����(��Fe3+������)�����������Fe3+ʣ�࣬˵������Ӧ���ܽ��е��� ���Թ��м���5 mL 0.1 mol��L-1 KI��Һ��2�ε�����Һ���������pH=5 c(I-)�͡�c(H+)�� ����I-+I2
2Fe2++I2 ʵ���ͨ������KI����(��Fe3+������)�����������Fe3+ʣ�࣬˵������Ӧ���ܽ��е��� ���Թ��м���5 mL 0.1 mol��L-1 KI��Һ��2�ε�����Һ���������pH=5 c(I-)�͡�c(H+)�� ����I-+I2![]() I3-��ʹc(I2)��С��2Fe3++2I-
I3-��ʹc(I2)��С��2Fe3++2I-![]() 2Fe2++I2 �����ƶ���c(Fe3+)��С��Fe3++3SCN-
2Fe2++I2 �����ƶ���c(Fe3+)��С��Fe3++3SCN-![]() Fe(SCN)3�����ƶ�����ɫ��dz ��1֧�Թ��м���2 mL 0.1 mol��L-1 KI��Һ���ٵμ�0.1 mol��L-1 FeCl3��Һ2��3�Σ��μ�2��0.1 mol��L-1 KSCN��Һ��֮��ÿ���5 min����ȡ1֧�Թ��ظ�����ʵ�飬�۲�4֧�Թ�����Һ��ɫ�ı仯
Fe(SCN)3�����ƶ�����ɫ��dz ��1֧�Թ��м���2 mL 0.1 mol��L-1 KI��Һ���ٵμ�0.1 mol��L-1 FeCl3��Һ2��3�Σ��μ�2��0.1 mol��L-1 KSCN��Һ��֮��ÿ���5 min����ȡ1֧�Թ��ظ�����ʵ�飬�۲�4֧�Թ�����Һ��ɫ�ı仯
��������
(1)���ݵⵥ�ʵ�������Ӧ�ش�
(2)���Fe3+��I-���ɵⵥ�ʣ���д����ƽ������ԭ��Ӧ����ʽ��
(3)������������KSCN��Һ����ɫ��Ӧ���ͣ�
(4)��֪�����Խ�ǿ�������£�I-�ɱ���������ΪI2�����ʵ��������������������¹۲췴Ӧ��������жϣ�������Һ�����������ؿ���������Ũ�ȵ͵�ԭ��
(5)����I-+I2I3-��2Fe3++2I-2Fe2++I2��Fe3+3SCN-Fe(SCN)3�����ƽ���ƶ���ԭ���������
(6)����FeCl3��KI�ķ�Ӧ��I-��I2�ķ�Ӧ�ﵽƽ����Ҫһ��ʱ�䣬�п���20min֮ǰ��δ�ﵽƽ�⣬Ϊ��֤�ü��裬������4֧�Թܷ��Ĵ���ʵ�飬�õ���ɫ��dz������ĸ���ɫ��Һ��ϵ��
(1)ȡ5mL0.1molL-1KI��Һ���μ�0.1molL-1FeCl3��Һ5��6��(�����ҺpH=5)����Һ��Ϊ�ػ�ɫ��֤��ʵ��������I2���ɣ�����ⵥ�ʿ���ѡ�õ�����Һ����Һ����ɫ˵�������˵ⵥ�ʣ��ʴ�Ϊ��������Һ��
(2)ʵ������Fe3+��I-����������ԭ��Ӧ���ɵⵥ�ʺ��������ӣ���Ӧ�����ӷ���ʽΪ��2Fe3++2I-2Fe2++I2���ʴ�Ϊ��2Fe3++2I-=I2+2Fe2+��
(3)ʵ����ȡ2mLʵ������Ӧ�����Һ���μ�2��0.1molL-1KSCN��Һ����Һ���ɫ��˵��KI������ǰ�����Ժ������ӣ�˵����Ӧ���ܽ��г��ף�֤����ӦΪ���淴Ӧ���ʴ�Ϊ��ʵ������KI������ǰ���·�Ӧ���Ժ������ӣ�˵����Ӧ���ܽ��г��ף�֤����ӦΪ���淴Ӧ��
(4)��֪�����Խ�ǿ�������£�I-�ɱ���������ΪI2���ʼ�ͬѧ������裺�÷�Ӧ�����¿�����I-����ΪI2��ʹʵ��������Һ�ػ�ɫ�����ͬѧ�����������ʵ�飺���Թ��м���5mL0.1molKI��Һ��2�ε�����Һ���������pH=5��20min����Һ��������֤���ü��費������������Һ�����������ؿ�����I-Ũ�ȵ͡�H+Ũ�ȵͣ��ʴ�Ϊ�����Թ��м���5mL0.1molKI��Һ��2�ε�����Һ���������pH=5��c(I-)�͡�c(H+)�ͣ�
(5)ʵ������20min����Һ��ɫ��dz��ԭ�����ڴ��ڻ�ѧƽ��I-+I2I3-�������ӹ�������ⵥ��Ũ�ȼ�СΪ��Ҫ���أ�ʹ��2Fe3++2I-2Fe2++I2ƽ��������У�������Ũ�ȼ�С������Fe3+3SCN-Fe(SCN)3ƽ��������У���Һ��ɫ��dz���ʴ�Ϊ�����ڴ��ڻ�ѧƽ��I-+I2I3-��ʹc(I2)��С��2Fe3++2I-2Fe2++I2ƽ��������У�c(Fe3+)��С��Fe3+3SCN-Fe(SCN)3ƽ��������У���Һ��ɫ��dz��
(6)��ͬѧ���20min���ʵ���������������裺FeCl3��KI�ķ�Ӧ��I-��I2�ķ�Ӧ�ﵽƽ����Ҫһ��ʱ�䣬�п���20min֮ǰ��δ�ﵽƽ�⡣Ϊ��֤�ü��裬��ͬѧ��4֧�Թܽ���ʵ�飬�õ�����ɫ��dz������ĸ���ɫ��Һ��ϵ������ʵ�鷽��Ϊ����1֧�Թ��м���2mL0.1mol/LKI��Һ���ٵ���0.1mol/L��FeCl3��Һ2-3�Σ��μ�2��KSCN��Һ��֮��ÿ���5min��ȡ1֧�Թ��ظ�����ʵ�飬�۲�4֧�Թ�����Һ��ɫ�仯���ʴ�Ϊ����1֧�Թ��м���2mL0.1mol/LKI��Һ���ٵ���0.1mol/L��FeCl3��Һ2-3�Σ��μ�2��KSCN��Һ��֮��ÿ���5min��ȡ1֧�Թ��ظ�����ʵ�飬�۲�4֧�Թ�����Һ��ɫ�仯��


 ����ͼ���������������ϵ�д�
����ͼ���������������ϵ�д� ����ѧҵ���Ե�����ϵ�д�
����ѧҵ���Ե�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£�����������γɵĻ������Ϊ�����������Cu9Al4��Cu5Zn8�ȡ�
(1)ij��������������Է��ԣ�ԭ������ά�ռ�����������������У��ý�������������________(���������������Ǿ�����)��
(2)��̬ͭԭ����________��δ�ɶԵ��ӣ�Cu2���ĵ����Ų�ʽΪ____________________����CuSO4��Һ�м��������ˮ����ַ�Ӧ����������Ҵ�������һ������ɫ���壬�þ���Ļ�ѧʽΪ____________________����������ѧ����____________________���Ҵ�������Cԭ�ӵ��ӻ��������Ϊ________��
(3)ͭ������±��(SCN)2��Ӧ����Cu(SCN)2,1 mol(SCN)2�����к�����������ĿΪ________��(SCN)2��Ӧ������������(H��S��C��N)����������(H��N===C===S)���֡�������ǰ�߷е���ں��ߣ���ԭ����______________________________________________________________________________________��

(4)ZnS�ľ����ṹ��ͼ��ʾ����ZnS�����У�S2������λ��Ϊ_______________��
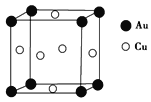
(5)ͭ����γɵĽ���������ľ����ṹ��ͼ��ʾ���侧���߳�Ϊa nm���ý�����������ܶ�Ϊ________ g��cm��3(�ú�a��NA�Ĵ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����Ĥ��ϵ��װ������ѭ��������NaOH��Һ�ڷ�Ӧ��������β���еĶ��������õ���Na2SO3��Һ���е�����Ƶ�NaOH������a��b���ӽ���Ĥ�����۷�Ϊ�������缫����Ϊʯī����ƷCΪH2SO4��Һ������˵����ȷ���ǣ� ��

A. bΪֻ����������ͨ�������ӽ���Ĥ
B. ��������B�������ϡNaOH��Һ����ƷEΪ����
C. ��Ӧ�ز�������Һ������ʽ��Ŀ����ʹ��Ӧ�����
D. �����ĵ缫��ӦʽΪSO32-��2e����H2O===2H����SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ��ҵ�ϳɰ���ԭ������N2(g)+3H2(g)![]() 2NH3(g) ��H=-93.0kJ/mol
2NH3(g) ��H=-93.0kJ/mol
(1)��֪һ����������2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g) ��H=+1530.0kJ/mol�����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽΪ____________________��
4NH3(g)+3O2(g) ��H=+1530.0kJ/mol�����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽΪ____________________��
(2)�ں��º���װ���н��кϳɰ���Ӧ�������Ũ��-ʱ��ͼ�����¡�

�� ��ʾN2Ũ�ȱ仯�������� (�����)��
�� ǰ25min �ڣ���H2Ũ�ȱ仯��ʾ�Ļ�ѧ��Ӧ������ ��
�� ��25minʱ����ȡ���д�ʩ����ʹN2��ת������ߵ���__________(�����)��
a. ͨ��1molN2
b. ͨ��1molH2
c. ͨ��1molHe��
d. ͨ��1molHCl
e. ͨ��1molN2��3molH2
(3)�ں��º�ѹװ���н��й�ҵ�ϳɰ���Ӧ������˵���������__________(�����)��
a������������ٱ仯������ƽ��
b�������ܶȲ��ٱ仯������ƽ��
c��ƽ���ѹ�������������ɸ���NH3
d��ƽ�����װ����ͨ��һ����Ar��ƽ�ⲻ�ƶ�
(4)�糧�����ѵ�������ӦΪ����4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) ��H<0
5N2(g)+6H2O(g) ��H<0
����ӦΪ����2NH3(g)+8NO(g)![]() 5N2O(g)+3H2O(g) ��H>0
5N2O(g)+3H2O(g) ��H>0
ƽ��������N2��N2O�������¶ȵĹ�ϵ��ͼ��ʾ��

��ش���400��600Kʱ�����¶ȵ����ߣ�ƽ��������N2����_____________(������������������������������)���������ֹ��ɵ�ԭ����_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��3-����ૼ״��Ǻϳ�ũҩ�氷���м��壬��ϳ�·�����£�

��֪���� RCl ![]() NCN
NCN ![]() RCOOH
RCOOH
�� R1COOR2 + R318OH ![]() R1CO18OR3 + R2OH
R1CO18OR3 + R2OH
�� R1COOR2 ![]() R1CH2OH + R2OH
R1CH2OH + R2OH
��ش��������⣺
��1��A����B�ķ�Ӧ������__________��B�к��еĹ�������___________��
��2��D����������Ӧ����E�Ļ�ѧ����ʽΪ___________��
��3��3-����ૼ״��ж���ͬ���칹�壬��д���������ַ��������������л���Ľṹ��ʽ��______________________��
���ܷ���ˮ�ⷴӦ �ڷ�������3����
��4��G�Ľṹ��ʽΪ__________��
��5������G�Ĺ����г����и���Ӧ��������д��һ�����������ɸ߷��Ӿۺ���Ļ�ѧ����ʽ��________��
��6������������![]() ��K�����ӳɷ�Ӧ�ϳ�3-����ૼ״���д��K��H�Ľṹ��ʽ��___________________��__________________��
��K�����ӳɷ�Ӧ�ϳ�3-����ૼ״���д��K��H�Ľṹ��ʽ��___________________��__________________��
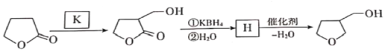
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����100mL0.100molL��1Na2CO3��Һ�ļ����ؼ�ʵ�鲽��Ͳ�������ͼ�ش��������⣺
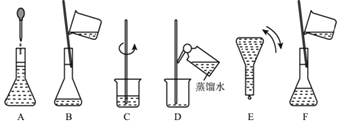
��1��������ƿ����һ�����ʵ���Ũ�ȵ���Һ��������ƿ������_____��
������� ��ƿ����©ˮ�� ���������Ƶ���Һ��ϴ���� �������������Ҫ���
��2������Na2CO310H2O��������Һ����Ҫ��������_____�ˡ�������ȡ�ľ����Ѿ���һ����ʧȥ�˽ᾧˮ���������Ƶ���ҺŨ��ƫ_____�������/С����
��3��д��������Һ������Ҫ�õ��IJ������������ƣ��ձ���_____��
��4������Bͨ����Ϊת�ƣ�����Aͨ����Ϊ_____������D��Ϊ_____����û�в���D�������Ƶ�Ũ��ƫ_____�������/С������
��5��������ʵ�鲽��A��F��ʵ������Ⱥ��������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ��̽������ʵ��(A)��
ʵ��A | ���� | ���� |
| ���� | i�����Ⱥ���ɫ��ȥ ii����ȴ�����У���Һ�ָ���ɫ ��.һ��ʱ�����ɫ������ȥ |
��1��ʹ���۱�����������____��
��2����������i��ii��Ϊ�������������£����ȴٽ�����ˮ�⣬��ȴ��ƽ�������ƶ���
���ʵ�����£�������a��֤ʵ�÷�����������

������a����____��
��3���ٴη��������Ⱥ��ʵⷢ���˱仯��ʵ�����£�
I��ȡ������ˮ����������ɫ���õ�����Һ����ӷ��������ʣ�������
������ɫ�����Һ�еμӵ�����Һ����ȴ������һֱδ����������ϡH2SO4��˲�������
�Բ������ϡH2SO4�����ã�������ӷ���ʽ�����һ�ֺ����Ľ��ͣ�______________��
��4��̽����ˮ��ɫ����Һ�ijɷ֣�
ʵ��1�������Һ��pH��5
ʵ��2��ȡ��ɫ�����Һ���������ʵ�飺

�ٲ�����ɫ���������ӷ���ʽ��____��
��Ag2O��������____________��
����������ʵ�飬�Ʋ���Һ�к��е����ʣ������ӣ�������_________��
��5����ϻ�ѧ��Ӧ���ʽ���ʵ��A������i������iii��ɫ��ȥ��ԭ��_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��pKa=��lgKa��25��ʱ�����������pKaֵ���±���ʾ������˵����ȷ����
����Ļ�ѧʽ | CH3COOH | HCOOH | H2SO3 |
pKa | 4.74 | 3.74 | 1.90 7.20 |
A. ��Na2SO3��Һ�м���������ᣬ��Ӧ����SO2
B. 25��ʱ��pH=8�ļ�������Һ�У�c( HCOOH)=9.9��10��7mol��L-1
C. 25��ʱ��ij������ҺpH=a�����Ũ�ȵļ���pH=a��1
D. ��ͬ�¶��£���Ũ�ȵ� HCOONa��Һ��Na2SO3��Һ��pH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����˫���ű�����з�Ӧ�е���ת�Ƶķ������Ŀ����ָ���������ͻ�ԭ����
(1) Cl2 + SO2 + 2H2O = H2SO4 + 2HCl_______������_______����ԭ��______��
(2)2Fe��3Cl2![]() 2FeCl3_______������______����ԭ��_______��
2FeCl3_______������______����ԭ��_______��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com