
 四种短周期元素在周期表中的相对位置如图所示,下列说法错误的是( )
四种短周期元素在周期表中的相对位置如图所示,下列说法错误的是( )| A、X和Y元素的原子最外层电子数之和等于Z元素的原子最外层电子数的2倍 |
| B、Y元素的非金属性强于W元素的,其最高价氧化物水化物的酸性也强于W的 |
| C、X最简单氢化物溶于水呈碱性,Z最简单氢化物溶于水呈酸性 |
| D、W元素形成的单质可以从Z元素氢化物的水溶液中置换出Z单质 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、1mol 氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4 L |
| B、等体积、浓度均为1mol/L的碳酸和盐酸,电离出的氢离子数之比为2:1 |
| C、1mol臭氧和1.5mol氧气含有相同的氧原子数 |
| D、等物质的量的干冰和葡萄糖(C6H12O6)中所含氧原子数之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(A2-)+c(OH-)=c(H2A)+c(H+) |
| B、c(HA-)>c(A2-)>c(H2A) |
| C、c(HA-)>c(H+)>c(OH-) |
| D、c(HA-)>c(OH-)>c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
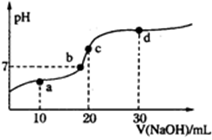 常温时向20mL 0.1mol?L-1 HA溶液中不断滴入0.1mol?L-1 NaOH溶液,pH变化如图.下列叙述正确的是( )
常温时向20mL 0.1mol?L-1 HA溶液中不断滴入0.1mol?L-1 NaOH溶液,pH变化如图.下列叙述正确的是( )| A、HA的电离方程式:HA═H++A- |
| B、水的电离程度:a点>b点 |
| C、c点溶液:c(H+)+c(Na+)═c(A-)+c(HA) |
| D、d点溶液:c(Na+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A、L2+与R2-的核外电子数相等 |
| B、气态氢化物的热稳定性:H2T>H2R |
| C、M与T形成的化合物能溶于氨水溶液 |
| D、相同条件下,单质与同浓度稀盐酸反应的速率:M>L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N5+常温下会剧烈爆炸,体积急剧膨胀,放出大量的热 |
| B、N60的发现开辟了能源世界的新天地,将来可能成为很好的火箭燃料 |
| C、N2、N3、N5、N5+、N60互为同素异形体 |
| D、含N5+的化合物中既有离子键又有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应中被氧化与被还原的元素,其原子的物质的量之比为1:2 |
| B、NF3与NH3化学性质的不同是因F与H两元素非金属性的差异引起 |
| C、NF3一旦泄漏,可用NaOH溶液喷淋,只有NaF、NaNO3和H2O产生 |
| D、若反应中转移0.2mol电子,则生成的NO气体体积约为4.48L(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com