
 3Z��g����H��O
3Z��g����H��O| c3(z) |
| c(x)?c2(y) |
| c3(z) |
| c(x)?c2(y) |
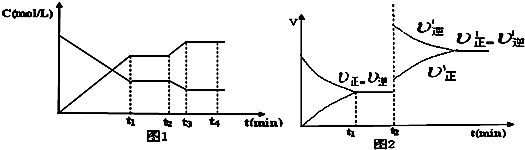
| c3(z) |
| c(x)?c2(y) |
| c3(z) |
| c(x)?c2(y) |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ʱ��/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c��NH3��/mol?L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
| N2 | H2 | NH3 | |
| ��ʼŨ�ȣ�mol/L�� | 0.2 | 0.3 | 0.2 |
| ƽ��Ũ�ȣ�mol/L�� | a | b | c |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
��֪��N2��g����3H2��g��2NH3��g����H����92.4kJ/mol������Ŀǰ�ձ�ʹ�õ��˹��̵��ķ�������ش��������⣺
(1)450��ʱ����һ��2L���ܱ������г���2. 6mol H2��1mol N2�� ��Ӧ�����ж�NH3��Ũ�Ƚ��м�⣬�õ����������±���ʾ��
| ʱ��/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol��L��1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
��5 min�ڣ�����N2��ƽ����Ӧ����Ϊ_______________���������¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K=_______________����Ӧ�ﵽƽ�������ƽ����ϵ�м���H2��N2��NH3��2mol����ʱ�÷�Ӧ��v��N2����_______________v��N2��������д��>������=����<��=����
�����и�������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������__________���������ĸ��
A��������N2��H2��NH3��Ũ��֮��Ϊ1��3��2
B��v��N2����=3v��H2���� C.������ѹǿ���ֲ���
D�����������ܶȱ��ֲ��� E.�����ڻ�������ƽ������������
�����ı�ijһ����������ƽ��ʱn(H2)=1.60mol ������˵����ȷ����_____________��
A.ƽ��һ�������ƶ� B.�������������м�����һ������H2����
C.�����ǽ������������¶� D.��������С�����������
��2��450��ʱ������һ�ܱ������н��������ϳɰ��ķ�Ӧ�������ʵ���ʼŨ�Ⱥ�ƽ��Ũ�����±���ʾ��
|
| N2 | H2 | NH3 |
| ��ʼŨ�ȣ�mol/L�� | 0.2 | 0.3 | 0.2 |
| ƽ��Ũ�ȣ�mol/L�� | a | b | c |
��ش�
�ٸ����ʵ�ƽ��Ũ�ȿ�����_______________��
A��c=0.5mol/L B��b=0.5mol/L C��c=0.4mol/L D��a=0.3mol/L
��a��ȡֵ��Χ�ǣ�_______________��
��������ѧ����ʽ��ʾ������֮��Ĺ�ϵ��
(I)a��b�Ĺ�ϵ��_______________��
(��)a��b��c�Ĺ�ϵ��_______________��
(3) �������¡��˹��̵������о��������ڳ��¡���ѹ�����������£�N2�ڴ�������������Fe2O3��TiO2��������ˮ�ɷ������з�Ӧ��2N2��g����6H2O(l) 4NH3��g����3O2��g�����˷�Ӧ�ġ�S__________0���
���� ��
����=������ ��H��_____________��
����֪��H2��ȼ����Ϊ285.8 kJ/mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ�꽭��ʡЭ��������ڶ������������ۣ���ѧ���� ���ͣ������
��֪��N2��g����3H2��g�� 2NH3��g����H����92.4kJ/mol������Ŀǰ�ձ�ʹ�õ��˹��̵��ķ�������ش��������⣺
2NH3��g����H����92.4kJ/mol������Ŀǰ�ձ�ʹ�õ��˹��̵��ķ�������ش��������⣺
(1)450��ʱ����һ��2L���ܱ������г���2. 6mol H2��1mol N2�� ��Ӧ�����ж�NH3��Ũ�Ƚ��м�⣬�õ����������±���ʾ��
|
ʱ��/min |
5 |
10 |
15 |
20 |
25 |
30 |
|
c(NH3)/mol��L��1 |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
��5 min�ڣ�����N2��ƽ����Ӧ����Ϊ_______________���������¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K=_______________����Ӧ�ﵽƽ�������ƽ����ϵ�м���H2��N2��NH3��2mol����ʱ�÷�Ӧ��v��N2����_______________v��N2��������д��>������=����<��=����
�����и�������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������__________���������ĸ��
A��������N2��H2��NH3��Ũ��֮��Ϊ1��3��2
B��v��N2����=3v��H2���� C.������ѹǿ���ֲ���
D�����������ܶȱ��ֲ��� E.�����ڻ�������ƽ������������
�����ı�ijһ����������ƽ��ʱn(H2)=1.60mol ������˵����ȷ����_____________��
A.ƽ��һ�������ƶ� B.�������������м�����һ������H2����
C.�����ǽ������������¶� D.��������С�����������
��2��450��ʱ������һ�ܱ������н��������ϳɰ��ķ�Ӧ�������ʵ���ʼŨ�Ⱥ�ƽ��Ũ�����±���ʾ��
|
|
N2 |
H2 |
NH3 |
|
��ʼŨ�ȣ�mol/L�� |
0.2 |
0.3 |
0.2 |
|
ƽ��Ũ�ȣ�mol/L�� |
a |
b |
c |
��ش�
�ٸ����ʵ�ƽ��Ũ�ȿ�����_______________��
A��c=0.5mol/L B��b=0.5mol/L C��c=0.4mol/L D��a=0.3mol/L
��a��ȡֵ��Χ�ǣ�_______________��
��������ѧ����ʽ��ʾ������֮��Ĺ�ϵ��
(I)a��b�Ĺ�ϵ��_______________��
(��)a��b��c�Ĺ�ϵ��_______________��
(3) �������¡��˹��̵������о��������ڳ��¡���ѹ�����������£�N2�ڴ�������������Fe2O3��TiO2��������ˮ�ɷ������з�Ӧ��2N2��g����6H2O(l)  4NH3��g����3O2��g�����˷�Ӧ�ġ�S__________0���
4NH3��g����3O2��g�����˷�Ӧ�ġ�S__________0��� ���� ��
���� �� ����=������ ��H��_____________��
����=������ ��H��_____________��
����֪��H2��ȼ����Ϊ285.8 kJ/mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2009-2010ѧ�갲��ʡ������DZɽ��Ұկ��ѧ�߶����ϣ����л�ѧ�Ծ��������棩 ���ͣ������
 3Z��g����H��O
3Z��g����H��O
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com