
(14��)CO��SO2����Ҫ�Ĵ�����Ⱦ���壬���û�ѧ��Ӧԭ����������Ⱦ����Ҫ������
I���״����Բ���Ͳ������ʯ��ȼ�ϣ�������Դ���š�����CO���Ժϳɼ״���
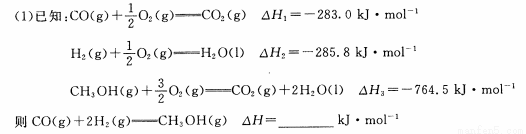
��2��һ�������£����ݻ�ΪVL���ܱ������г���� mol CO��2a mol H2�ϳɼ״�ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
��P1�ߣ�P2(���������������=��)��������
�ڸü״��ϳɷ�Ӧ��A���ƽ�ⳣ��K= (��a��V��ʾ)
�۸÷�Ӧ�ﵽƽ��ʱ����Ӧ��ת���ʵĹ�ϵ��:CO H2(����� �������� ��=�� )
�����д�ʩ���ܹ�ͬʱ��������Ӧ���ʺ����COת���ʵ��� ��(��д��Ӧ��ĸ)
A��ʹ�ø�Ч����
B�����ͷ�Ӧ�¶�
C��������ϵѹǿ
D�����Ͻ�CH30H�ӷ�Ӧ������з������
E�����ӵ����ʵ�����CO��H2
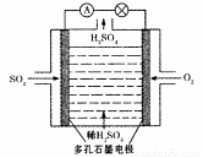
��ijѧϰС����SO2Ϊԭ�ϣ����õ绯ѧ������ȡ���ᡣ
��3��ԭ��ط�:��С����Ƶ�ԭ���ԭ����ͼ��ʾ��д���õ�ظ����ĵ缫��Ӧʽ ��
��4����ⷨ:��С����Na2SO3��Һ�������S02�õ�NaHSO3��Һ��Ȼ�������Һ�Ƶ������ᡣԭ������ͼ��ʾ��
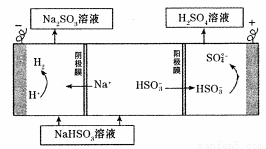
д����ʼ���ʱ�����ĵ缫��Ӧʽ ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�����и߶�3���¿���ѧ�Ծ��������棩 ���ͣ������
��11�֣���ҵ����ȡ����ʯ(Na3AlF6)�Ļ�ѧ����ʽ���£�
2Al(OH)3+ 12HF+ 3 A = 2Na3AlF6+ 3CO2��+ 9H2O
�����������������գ�
��1����Ӧ��A�Ļ�ѧʽΪ ������ ���塣
��2�����������ɷ�����ɵ��������ڼ��Է��ӵ��� ��д����ʽ�����ɷ�����ɵľ������۵�ϸߵ��� ��д����ʽ�����ɷ�����ɵľ������ܶȽϴ���� ��д����ʽ��
��3����Ӧ����������Ԫ����Ԫ�����ڱ���λ�����ڣ�����һ����ѧ����ʽ����ʾ���ǵķǽ����ԵĴ�С ������д�����е縺�Խ�С��Ԫ��ԭ�ӵļ۲������ ��ͼ�� ��
��4����ȡ����ʯ(Na3AlF6)�Ļ�ѧ����ʽ�г����⣬����ԭ�ӵĵ�һ�������ɴ�С��˳��
��5������ʯ��Na3AlF6�������ӻ���������������ɣ�����ʯ�����ṹ��ͼ��ʾ����λ�ڴ������嶥������� ����λ�ڴ��������12������е��8��С����������ģ���ô������������Ĵ��������������� �������������ţ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���½���³ľ����������ڶ�������Բ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪ƽ�⣺��C2H4(g)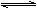 C2H2(g)��H2(g)����2CH4(g)
C2H2(g)��H2(g)����2CH4(g)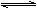 C2H4(g)��2H2(g)���������¶�ʱ���ٺ͢�ʽ�������ƶ���
C2H4(g)��2H2(g)���������¶�ʱ���ٺ͢�ʽ�������ƶ���
��1��C(s)��2H2(g)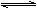 CH4(g)
CH4(g) 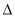 H1
H1
��2��2C(s)��H2(g)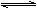 C2H2(g)
C2H2(g) 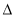 H2
H2
��3��2C(s)��2H2(g)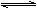 C2H4(g)
C2H4(g) 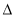 H3
H3
�����йأ�1������2���ͣ�3���е�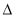 H1��
H1��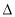 H2��
H2��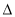 H3��С˳��������ȷ����
H3��С˳��������ȷ����
A��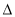 H1��
H1��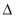 H2��
H2�� H3 B��
H3 B��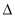 H2��
H2��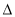 H3��2
H3��2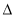 H1
H1
C��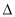 H2��
H2��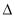 H1��
H1��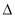 H3 D��
H3 D�� H3��
H3�� H2��2
H2��2 H1
H1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�������ʡ������ѧ�ڵ�һ��ģ����ѧ�Ծ��������棩 ���ͣ�ʵ����
(14��)��ͭ���ǹ�ҵ��ͭ����Ҫԭ�ϣ�����Ҫ�ɷ�ΪCuFeS2������һ����Ȼ��ͭ��(��SiO2)��Ϊ�˲ⶨ�û�ͭ��Ĵ��ȣ�ijͬѧ���������ʵ�飺
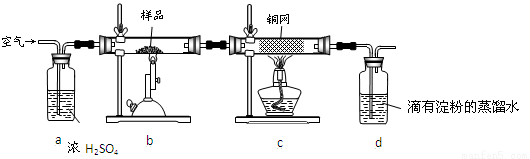
�ֳ�ȡ��ϸ�Ļ�ͭ����Ʒ1.84 g���ڿ��������½������գ�����Cu��Fe3O4��SO2���壬ʵ���ȡd����Һ�� ������ƿ�У���0.05 mol/L������Һ���еζ������ı���Һ20 mL����ش��������⣺
������ƿ�У���0.05 mol/L������Һ���еζ������ı���Һ20 mL����ش��������⣺
��1������Ʒ��ϸ���ٷ�Ӧ����Ŀ���� ��
��2��װ��a��c�����÷ֱ���_ ___��__ __(���ţ����Զ�ѡ)��
a����ȥSO2����
b����ȥ�����е�ˮ����
c��������������
d�������ڹ۲��������
e����ȥ��Ӧ����������
��3��������Ӧ����������ͨһ��ʱ��Ŀ�������Ŀ���� ��
��4��ͨ�������֪���û�ͭ��Ĵ���Ϊ ��
��5��������ͼװ���������ʵ��װ��d��ͬ�����Դﵽʵ��Ŀ�ĵ��� (�����)��
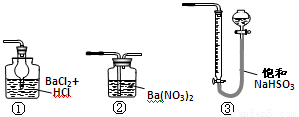
��6������ԭװ��d�е���Һ��ΪBa(OH)2����õĻ�ͭ�Ȼ����������ʵ���������ȷ�����ܵ�ԭ����Ҫ��_______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�������ʡ������ѧ�ڵ�һ��ģ����ѧ�Ծ��������棩 ���ͣ�ѡ����
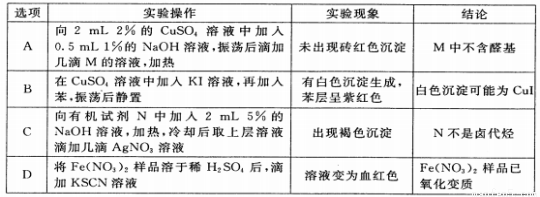
���ж�ͼ��������ȷ����

A��ͼ�ٱ�ʾ�����pHֵ����ͬ��ϡ����ʹ��ᣬ��������þ��Ӧ����H2���Ĺ�ϵ
B��ͼ�ڱ�ʾ��NaOH��Һ�еμ�ϡ���ᣬ��Һ�����Ա仯�Ĺ�ϵ
C��ͼ�۱�ʾ2SO2(g)��O2(g) 2SO3(g)��Ӧ�����У�SO2��O2��Ӧ���ʴ�С��ϵ
2SO3(g)��Ӧ�����У�SO2��O2��Ӧ���ʴ�С��ϵ
D��ͼ�ܱ�ʾ��ˮ�еμ�ϡ����ʱ����Һ��pH��С�仯��ϵ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ֣���и����ڶ�������Ԥ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
���и���ʵ�������ʵ���������ó��Ľ��ۣ���ȷ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�걱���������ظ���3��ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ������
(14��)SO2 ��CO ��NOx �ǶԻ���Ӱ��ϴ�����壬�����ǵĺ������ƺ��������Ż��������滷������Ч;������ش��������⣺
��1����֪25�桢101kPaʱ��
2SO2(g) + O2(g)  2SO3(g) ��H1 = - 197 kJmol-1
2SO3(g) ��H1 = - 197 kJmol-1
H2O(g) = H2O(l) ��H2 = - 44 kJmol-1
2SO2(g) + O2(g) + 2H2O(g) = 2H2SO4(l) ��H3 = - 545 kJmol-1
��SO3(g)��H2O(l)��Ӧ���Ȼ�ѧ����ʽ�� ��
��2������Ӧ2H2��g��+ O2 ��g��=2H2O��g ��,��H=-241.8kJmol-1�������±�������x=______kJmol-1��
��ѧ�� | H-H | O�TO | O-H |
�Ͽ�1mol��ѧ�����������/kJ | 436 | x | 463 |
��3���״�����Ҳ��һ������Դ���ȼ�ϡ���ҵ�Ͽ���CO��H2��ȡ�״����Ȼ�ѧ����ʽΪ��CO(g)+2H2(g) CH3OH(g) ��H=-90 kJmol-1
CH3OH(g) ��H=-90 kJmol-1
�ٸ��¶��£��������ݻ���Ϊ1 L���ܱ������У��ֱ����÷�Ӧ��
���� | �� | �� |
��Ӧ��Ͷ���� | 1 mol CO (g)��2 mol H2(g) | 1 mol CH3OH(g) |
ƽ��ʱc(CH3OH) | c1 | c2 |
ƽ��ʱ�����仯 | �ų�54kJ | ����a kJ |
��c1_________ c2(�������������),a=____________��
�����ܱ������ݻ������ͬ�������߷ֱ��ʾͶ�ϱȲ�ͬʱ�ķ�Ӧ���̡�����Ӧ��n(CO)��ʼ =10 mol��Ͷ�ϱ�Ϊ0.5����
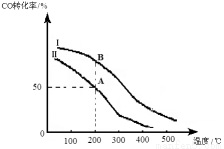
A���ƽ�ⳣ��KA= ��
B���ƽ�ⳣ��KB KA�� (�������������)
��Ϊ���COת���ʿɲ�ȡ�Ĵ�ʩ�� �����ٴ����������
��4�����NO�Ʊ�NH4NO3���乤��ԭ����ͼ��ʾ��
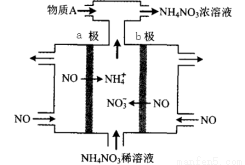
��a�缫����Ϊ_______��
b�缫��ӦʽΪ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�걱������ͷ��������3���ۺ���ϰ���ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�ס��ҡ��������л���Ľṹ��ʽ����ͼ��ʾ������˵������ȷ����
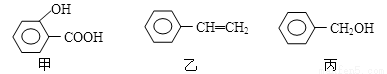
A���ס��ҡ������ܷ����ӳɷ�Ӧ��ȡ����Ӧ
B������C6H5OH�����У�OH������ͼ��ʾ���ʺɱ����ֵ���14����������ͬϵ��
C�����ۡ���֬���л������ȶ����ڸ߷��ӻ�����
D���ҵĻ�ѧ����Ϊ����ϩ����ʹ��ˮ��ɫ����������˳���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��㶫ʡ�ع��и������п������ۻ�ѧ�Ծ��������棩 ���ͣ������
��16�֣�����ȩ��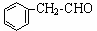 ����Ҫ��������Ҷ�У���Ũ�������������������ںϳ����ϡ���������ת����ϵ������C��ʹ������Ȼ�̼��Һ��ɫ��E��������������F��F����Է�������Ϊ90��
����Ҫ��������Ҷ�У���Ũ�������������������ںϳ����ϡ���������ת����ϵ������C��ʹ������Ȼ�̼��Һ��ɫ��E��������������F��F����Է�������Ϊ90��
��֪��
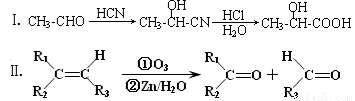
��1������ȩ�ķ���ʽΪ____________��B�о��еĹ������У������ƣ�_______________��
��2��д��Bת��ΪC��Ӧ�Ļ�ѧ����ʽ ���÷�Ӧ������ ��Ӧ��
��3��C��H2�����ӳɷ�Ӧ��1molC��������H2__________mol��
��4��E���ܾ��еĻ�ѧ�����У�����ţ�___________��
������H2�����ӳɷ�Ӧ
�����ڼ�����Һ�з���ˮ�ⷴӦ
��������ᷢ��������Ӧ
������Ag(NH3)2OH��Һ����������Ӧ
��5��B��ͬ���칹���ж��֣����з�������Ҫ����л�����________�֣���д������һ��ͬ���칹��Ľṹ��ʽ ��
����B������ͬ�Ĺ���������
�������Ȼ�����Һ����ɫ
�۱����ϵ�һ�ȴ���ֻ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com