
为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g,则该样品的纯度(质量分数)是( )
A.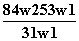 B.
B.
C.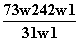 D.
D.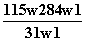
科目:高中化学 来源: 题型:
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到红色金属M和金属E并进行如下框图所示转化,获得高效净水剂K2EO4.(答题时,化学式及化学方程式中的M、E均用所对应的元素符号表示):

(1)写出M溶于稀H2SO4和H2O2混合液的离子方程式 。
(2)检验X中阳离子的方法和现象是
(3)某同学取酸化的X溶液在空气中放置后,再加入KI和淀粉溶液,溶液变为蓝色。写出与上述变化过程相关的离子方程式: 、 。
(4)由MSO4的蓝色溶液经一系列操作可以获得蓝色晶体,这些操作中用到的实验仪器除了酒精灯、蒸发皿、铁架台外,还需要用到的玻璃仪器有 (填写仪器名称)。
(5)某同学利用H2还原MO来测定M的相对原子质量,下图是测定装置示意图。A中试剂是盐酸。

①仪器B中应装入 ,装置D的作用 ;
②连接好装置并检验装置的气密性后,应首先“加热反应管E”还是“从A瓶中逐滴加入液体”?
在这两步之间还应进行的操作是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
向200毫升0.10mol/L的Fe(NO3)2溶液中加入适量NaOH溶液,使Fe2+完全转化成沉淀,过滤、洗涤,将所得的沉淀灼烧至质量不再变化,其质量为( )
A、1.44克 B、1.60克 C、4.36克 D、4.84克
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液,溶液中c(Na+) c(CH3COO-) (填“ >” 、“=”或“<”下同)
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 。
(4)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则原醋酸溶液中c(H+) 氢氧化钠溶液中c(OH-),m与n的大小关系是m n。
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学将金属钠露置于空气中,观察到下列现象:银白色 变灰暗
变灰暗 变白色
变白色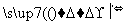 出现液滴
出现液滴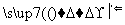 白色固体,根据钠及其化合物的性质分析,下列说法正确的是( )
白色固体,根据钠及其化合物的性质分析,下列说法正确的是( )
A.①发生了氧化还原反应
B.①变灰暗色是因为生成了过氧化钠
C.③是碳酸钠吸收空气中的水蒸气形成了溶液
D.④只发生物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关铁及其化合物的说法中正确的是( )
A.赤铁矿的主要成分是Fe3O4
B.铁与水蒸气在高温下的反应产物为Fe2O3和H2
C.除去FeCl3溶液中的FeCl2杂质可以向溶液中通入适量氯气
D.Fe3+与KSCN反应产生红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
浓硫酸具有:A.强酸性B.强氧化性C.高沸点、难挥发性D.脱水性E.吸水性等性质.以下过程主要表现了浓硫酸的哪些性质?请用题干字母分别填空.
(1).热的浓硫酸与铜片反应________________________
(2)浓硫酸干燥H2、O2、Cl2、HCl和SO2等气体______________________
(3)浓硫酸使湿润的蓝色石蕊试纸先变红后变黑________________________
ⅱ(4分)胃酸过多是常见的胃病之一,下面是甲、乙两种常见胃药的说明摘要.
甲:(1)白色结晶状粉末,酸式盐,焰色反应为黄色;(2)能溶于水,水溶液呈弱碱性;(3)遇酸则产生二氧化碳;(4)胃酸过多患者服用多见胃胀气,甚至有引起胃溃疡穿孔的危险.
乙:(1) 弱碱,与胃酸发生中和作用缓慢而持久;(2)凝胶本身覆盖于溃疡面上具有保护作用.(3)可溶于稀酸或氢氧化钠溶液中.
试写出甲中主要成分引起胃胀气的反应的离子方程式:________________________
试写出乙中的主要成分与氢氧化钠溶液反应的离子方程式:____________________.
ⅲ(2分)写出在呼吸面具里,二氧化碳转化为氧气的化学方程式:
________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
根据反应式:① 2Fe3+ + 2I- = 2Fe2+ + I2 ② Br2 + 2Fe2+ = 2Fe3+ + 2Br-可判断离子的还原性从强到弱的顺序是( )
A.Br- 、Fe2+ 、Cl- B.I- 、Fe2+ 、Br- C.Br- 、I- 、Fe2+ D.Fe2+ 、I- 、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
将BaCl2·xH2O的晶体2.44克溶于水,配成100毫升溶液.取此溶液25毫升,与50毫升0.1N的AgNO3溶液相作用,刚好把氯离子沉淀完全.
(1)求2.44克的BaCl2·xH2O的摩尔数.
(2)求BaCl2·xH2O的分子量.
(3)求BaCl2·xH2O中的x值.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com