
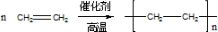 ,
,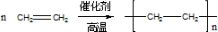 ;
;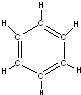 ,而大量实验事实和理论研究都表明,苯分子中6个碳原子之间的键完全相同,苯与溴发生取代反应生成溴苯和HBr,该反应为
,而大量实验事实和理论研究都表明,苯分子中6个碳原子之间的键完全相同,苯与溴发生取代反应生成溴苯和HBr,该反应为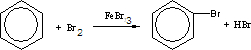 ,
, ;
;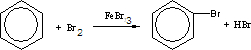 ;取代.
;取代.


科目:高中化学 来源: 题型:
| A、NH4Cl=NH3↑+HCl↑ |
| B、Mg+2HCl=MgCl2+H2↑ |
| C、CaO+CO2=CaCO3 |
| D、NaCl+AgNO3=AgCl↓+NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 |
HA物质的量 浓度/(mol?L-1) |
NaOH物质的量 浓度/(mol?L-1) |
混合后溶 液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
| c(OH-) |
| c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
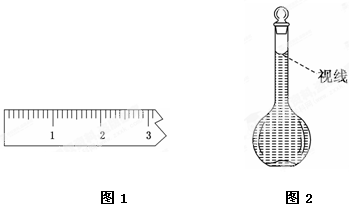
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
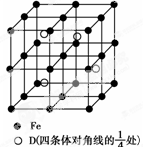 A、B、C、D分别代表四种不同的短周期元素.A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有1个电子.
A、B、C、D分别代表四种不同的短周期元素.A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有1个电子.查看答案和解析>>
科目:高中化学 来源: 题型:
 .将1mol化学式为CnH2n-4(不含C≡C和C=C=C结构)经上述方法处理后,得到的有机物和羰基(C=O)的物质的量不可能是( )
.将1mol化学式为CnH2n-4(不含C≡C和C=C=C结构)经上述方法处理后,得到的有机物和羰基(C=O)的物质的量不可能是( )| A | B | C | D | |
| 有机物 | 1mol | 3mol | 5mol | 4mol |
| 分子中羰基 | 2mol | 4mol | 8mol | 6mol |
| A、A |
| B、B |
| C、C D.D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com