
【题目】已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp (CaCO3)=2.8×10-9 Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法错误的是
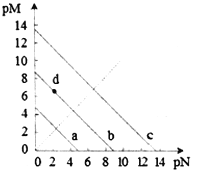
A. a线是CaSO4沉定溶解平衡曲线
B. T℃时,向10mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+)∶c(Pb2+)=
C. d点表示CaCO3的饱和溶液。且c(Ca2+)<c(CO32-)
D. T℃时,向CaSO4沉淀中加入1mol·L-1的Na2CO3溶液,CaSO4沉淀会转化为CaCO3沉淀
【答案】C
【解析】A. 由Ksp(CaSO4)=4.90×10-5得c(Ca2+)c(SO42-)=4.90×10-5,两边取负对数得:-lgc(Ca2+)- lgc(SO42-)=5-lg4.9,曲线在pN轴和pM轴上截距相等为5-lg4.9,与图中最接近的曲线为a,所以A正确;B. 在二者饱和溶液中,Ksp(CaCO)与Ksp(PbCO3)在计算中使用相同的c(CO32-),所以 ,所以B正确;C. 由A知曲线b为Ksp (CaCO3)=2.8×10-9曲线,d点表示CaCO3的饱和溶液。且c(Ca2+)>c(CO32-),所以C错误;D. 因为Ksp (CaCO3) < Ksp(CaSO4),所以当CaSO4沉淀中加入1mol·L-1的Na2CO3溶液后,Qc> Ksp (CaCO3),则CaSO4沉淀逐渐溶解,CaCO3沉淀逐渐生成,所以D正确,故选择C。
,所以B正确;C. 由A知曲线b为Ksp (CaCO3)=2.8×10-9曲线,d点表示CaCO3的饱和溶液。且c(Ca2+)>c(CO32-),所以C错误;D. 因为Ksp (CaCO3) < Ksp(CaSO4),所以当CaSO4沉淀中加入1mol·L-1的Na2CO3溶液后,Qc> Ksp (CaCO3),则CaSO4沉淀逐渐溶解,CaCO3沉淀逐渐生成,所以D正确,故选择C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是常见化合物或单质,有如下转化关系(略去条件和副产品)。

(1)若D为氧气,C为NaAlO2,E为NaOH,则B转化为C的离子方程式为_____________。
(2)若A、B、C均为钠盐溶液且A为Na2CO3,D、E均为卤素单质且有一种为黄绿色气体,则E的化学式为_______________。
(3)若B、D均为质子数小于18的元素原子形成的单质,A、C、E均为氧化物,其中E为SiO2,且D所含元素原子的质子数是B的2倍,A转化为B、B转化为C两个反应均属于置换反应,请写出A的电子式:______________,A转化为B的化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取乙酸乙酯的装置。请回答:

(1) 导管右端管口不伸入液面以下的原因是_______。
(2) 浓硫酸的作用是_________。
(3) 下列有关该实验的说法中,正确的是_______。
A.向a 试管中加入沸石,其作用是防止加热时液体暴沸
B.饱和碳酸钠溶液可以除去产物中混有的乙酸
C.乙酸乙酯是一种无色透明、密度比水大的油状液体
D.若原料为CH3COOH 和CH3CH218OH,则乙酸乙酯中不含18O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种难熔稀有金属,我国的钼储量居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。
(1)Mo可被发烟硝酸氧化,产物MoOF4和MoO2F2物质的量比为1∶1,完成下列方程式:____Mo+____HF+____HNO3=____ MoO2F2+____ MoOF4+____NO2↑+____ _________
(2)已知:①2Mo(s)+3O2(g)=2MoO3(s) ΔH1
②MoS2(s) +2O2(g)=Mo(s)+2SO2(g) ΔH2
③2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) ΔH3
则ΔH3 =_________(用含ΔH1、ΔH2的代数式表示),在反应③中若有0.2mol MoS2参加反应,则转移电子_______________mol。
(3)密闭容器中用Na2CO3(S)作固硫剂,同时用一定量的氢气还原辉钼矿(MoS2)的原理是:MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:

①由图可知,该反应的ΔH__0(填“>”或“<”);P2__________0.1MPa(填“>”或“<”)。
②如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是______(选填编号)。
A.v正(H2)=v逆(H2O)
B.再加入MoS2,则H2转化率增大
C.容器内气体的密度不变时,一定达平衡状态
D.容器内压强不变时,一定达平衡状态
③由图可知M点时氢气的平衡转化率为____(计算结果保留0.1%)。
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数Kp=______(MPa)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨、磷属于同一主族元素,是组成生命体的重要元素,其单质及化合物用途广泛。回答下列问题:
(1)基态P原子的核外电子排布式为_____,磷及其同周期相邻元素第一电离能由大到小的顺序是______________________。
(2)NH3比PH3易液化的原因是______________________。
(3)自然固氨现象发生的一系列化学变化:N2→NO→NO2→HNO3→NO3-解释了民谚“雷雨发庄稼”的原理。
①N2分子结构中。σ键和π键之比为_________,己知N![]() N的键能为946kJ·mol-1,远大于N—N的键能(193 kJ·mol-1)的三倍,原因是______________________。
N的键能为946kJ·mol-1,远大于N—N的键能(193 kJ·mol-1)的三倍,原因是______________________。
②NO3-中N原子采取___________杂化方式,其空间构型为__________,写出它的一种等电子体的化学式_____________________。
③已知酸性:HNO3>HNO2,下列相关见解合理的是_________________。
A.含氧酸中氧原子总数越多,酸性越强
B.同种元素化合价越高,对应含氧酸的酸性越强
C.HNO3中氮元素的正电性更高,在水溶液中更易电离出H+,酸性强于HNO2
(4)磷化硬(BP)是一种超硬耐磨涂层材料,其晶胞结构如图所示,图中a点和b点的原子坐标参数依次为(0,0,0)、(![]() ,
, ![]() ,
, ![]() ),则c 点的原子坐标参数为_______。已知该晶体密度为ρg·cm-3,则B-P键的键长为_____pm (阿伏加德罗常数用NA表示,列出计算式即可)。
),则c 点的原子坐标参数为_______。已知该晶体密度为ρg·cm-3,则B-P键的键长为_____pm (阿伏加德罗常数用NA表示,列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G[ ]是一种医药中间体,它的一种合成路线如下:
]是一种医药中间体,它的一种合成路线如下:

已知:
请回答下列问题:
(1)A的名称是_____________。
(2)B→C的反应条件为_____________。
A→B和D→E的反应类型分别是_____________、_____________。
(3)D在浓硫酸加热的条件下会生成一种含六元环的化合物,该化合物的结构简式为_____________。(4)H是一种高聚酯,D→H的化学方程式为_____________。
(5)下列关于化合物G的说法错误的是_____________。
A.G的分子式为C12H14O5
B.1molG与NaOH溶液加热最多消耗2molNaOH
C.一定条件下G发生消去反应生成的有机物存在顺反异构体
D.在一定条件下G能与HBr发生取代反应
(6)M是D的同分异构体,与D具有相同的官能团。则M可能的结构有____种。
(7)已知酚羟基不易与羧酸发生酯化反应,写出由苯酚,甲苯为原料制备苯甲酸苯酚酯(![]() )的合成路线(其它试剂任选)。 __________________
)的合成路线(其它试剂任选)。 __________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需要配制2mol/L的NaCl溶液920mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
A.920 mL,107.64 g
B.500 mL,117 g
C.1000 mL,117.0g
D.任意规格,107.64 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com