
【题目】(1)科学家发现,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒,这是因为对人体无害的+5价砷类化合物在维生素C的作用下能够转化为有毒的+3价的含砷化合物。通过以上信息填空:上述过程中+5价砷类物质作为______(填氧化剂或还原剂),+5价砷元素发生______反应(填氧化或还原);0.5mol+5价砷完全转化为+3价砷,共转移______个电子。
(2)实验室常用以下方法制取氯气:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
①用双线桥标出电子转移方向和数目______;(在答题纸上标)
②在标准状况下生成的氯气为11.2L时,被氧化的HCl的质量为______;
③为保证实验安全,常用氢氧化钠溶液吸收多余的氯气,写出反应的离子方程式______________________。
【答案】氧化剂 还原 NA 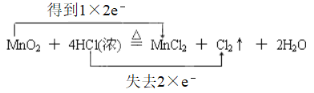 36.5g Cl2+2OH-=Cl-+ClO-+H2O
36.5g Cl2+2OH-=Cl-+ClO-+H2O
【解析】
(1)食用虾类等水生甲壳类动物中含有+5价砷类物质,与维生素C反应生成+3价砷类化合物,则维生素C具有还原性;根据砷元素的化合价变化进行计算;
(2)反应中Mn元素化合价从+4价降低到+2价,Cl元素化合价从-1价升高到0价,根据化合价升高数=化合价降低数=转移电子数以及氯气有毒分析解答。
(1)由对人体无害的+5价砷类化合物在维生素C的作用下,能够转化为有毒的+3价的含砷化合物,则砷元素的化合价降低,+5价砷类化合物为氧化剂,+5价砷元素发生还原反应;As元素由+5价降为+3价,降低2价,即得到2个电子,则0.5mol+5价砷完全转化为+3价砷时,共得到0.5mol×(5-3)=1mol,1mol电子即转移的电子数为NA。
(2)①反应4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O中,Mn元素化合价从+4价降低到+2价,得到2个电子,Cl元素化合价从-1价升高到0价,失去1个电子,根据电子得失守恒可知反应转移2个电子,则电子转移情况可表示为
MnCl2+Cl2↑+2H2O中,Mn元素化合价从+4价降低到+2价,得到2个电子,Cl元素化合价从-1价升高到0价,失去1个电子,根据电子得失守恒可知反应转移2个电子,则电子转移情况可表示为 ;
;
②标准状况下11.2LCl2的物质的量为:11.2L÷22.4/L=0.5mol,被氧化的HCl生成Cl2,根据氯原子守恒可知,被氧化的HCl的物质的量是Cl2的2倍,故被氧化的HCl为0.5mol×2=1mol,质量为m=n×M=1mol×36.5g/mol=36.5g;
③氯气有毒为保证实验安全,常用氢氧化钠溶液吸收多余的氯气,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。


科目:高中化学 来源: 题型:
【题目】根据你对金属钠性质的了解,回答下列问题:
(1)关于钠的叙述中,正确的是________(填字母)。
A.钠是银白色金属,硬度很大
B.将金属钠放在石棉网上,用酒精灯加热后金属钠剧烈燃烧,产生黄色火焰,生成过氧化钠
C.金属钠在空气中燃烧,生成氧化钠
D.金属钠的熔点很高
(2)由于金属钠很容易跟空气中的______、________等物质反应,通常将它保存在_______里。
(3)将一小块钠投入到下列溶液中,既能产生气体又会出现白色沉淀的是________(填字母)。
A.稀硫酸 B.硫酸铜溶液
C.氢氧化钠溶液 D.氯化镁溶液
(4)为粗略测定金属钠的相对原子质量,设计的装置如图所示,该装置(包括水)的总质量为ag,将质量为bg的钠(不足量)放入水中,立即塞紧瓶塞。完全反应后再称量此装置的总质量为cg。
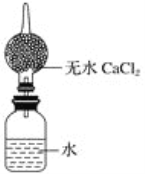
①列出计算钠相对原子质量的数学表达式______________(用含有a、b、c的算式表示)。
②无水氯化钙的作用是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如下图所示,电池总反应为2Ag+Cl2===2AgCl。下列说法正确的是( )

A. 正极反应为AgCl+e-===Ag+Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式不正确的是
A. 向Ba(OH)2溶液中逐滴加入NH4HS04溶液至刚好沉淀完全:Ba2++2OH-+H++SO42-+NH4+=BaSO4↓+NH3·H2O+H2O
B. 向Mg(HC03)2溶液中加入足量澄清石灰水:Mg2++2HCO3-+2Ca2++4OH-=2CaCO3↓+Mg(OH)2↓+2H2O
C. 氢氧化铁胶体的制备:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
D. 标准状况下将112mL氯气通入l0mL 1mol·L-l的溴化亚铁溶液中:2Fe3++4Br-+3Cl2=2Fe2++2Br2+6Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表各组物质之间通过一步反应不能实现如图所示转化的是( )

选项 | a | b | c |
A | Si | SiO2 | H2SiO3 |
B | SO2 | SO3 | H2SO4 |
C | NaOH | Na2CO3 | Na2SO4 |
D | NO | NO2 | HNO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1molN2,右边充入一定量的CO时,隔板处于如图位置(保持温度不变),下列说法正确的是( )

A.右边与左边分子数之比为4:1
B.右侧CO的质量为5.6 g
C.右侧气体密度是相同条件下氢气密度的14倍
D.若改变右边CO的充入量而使隔板处于容器正中间,保持温度不变,则应充入22.4 L的CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置来分离CO2和CO混合气体并干燥,图中a、c、d为止水夹,b为分液漏斗活塞,通过Y形管和止水夹分别接两个球胆,现装置内空气已排尽,为使实验成功,甲、乙、丙分别盛放的试剂为()
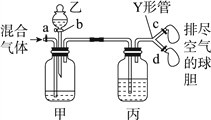
甲 | 乙 | 丙 | |
A | 饱和NaHCO3溶液 | 12 mol·L-1盐酸 | 18.4 mol·L-1 H2SO4 |
B | 饱和Na2CO3溶液 | 2 mol·L-1 H2SO4 | 饱和NaOH溶液 |
C | 饱和NaOH溶液 | 2 mol·L-1 H2SO4 | 18.4 mol·L-1 H2SO4 |
D | 18.4 mol·L-1 H2SO4 | 饱和NaOH溶液 | 18.4 mol·L-1 H2SO4 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知图一表示的是可逆反应CO(g)+H2(g) ![]() C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g) ![]() N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的是
N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的是
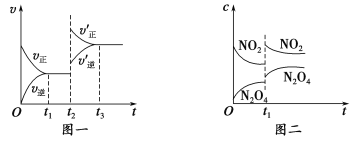
A.图一t2时改变的条件可能是升高了温度或使用了催化剂
B.若图一t2时改变的条件是增大压强,则反应的ΔH增大
C.图二t1时改变的条件可能是升高了温度或增大了压强
D.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com