
用石墨电极电解100 mL H2SO4与CuSO4的混合溶液,通电一段时间后,阴、阳两极分别收集到2.24 L和3.36 L气体(标准状况),溶液要想恢复电解前的状态可加入下列( )
A.0.1 mol CuO
B.0.1 mol CuCO3
C.0.1 mol Cu(OH)2
D.0.1 mol Cu2(OH)2CO3
科目:高中化学 来源: 题型:
过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
 CaCl2固体 30%的H2O2
CaCl2固体 30%的H2O2











NH3 副产品 产品
已知CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是________________________________________________________________________
________________________________________________________________________。
(2)检验“水洗”是否合格的方法是________。
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是(写出两种):
①________________________________________________________________________;
②________________________________________________________________________。
(4)测定产品中CaO2含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
(已知:I2+2S2O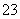 ===2I-+S4O
===2I-+S4O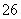 )
)
①CaO2的质量分数为____________(用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________(填“不受影响”、“偏低”或“偏高”),原因是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示(电极材料为石墨)。
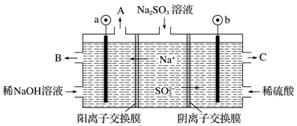
(1)图中a极要连接电源的________(填“正”或“负”)极,C口流出的物质是________。
(2)SO 放电的电极反应式为____________。
放电的电极反应式为____________。
(3)电解过程中阴极区碱性明显增强,用平衡移动原理解释原因________。
查看答案和解析>>
科目:高中化学 来源: 题型:
PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为________________________________;PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式为__________________________,阴极上观察到的现象是________________;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为________________________,这样做的主要缺点是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是用铁铆钉固定两个铜质零件的示意图,若该零件置于潮湿空气中,下列说法正确的是( )
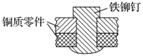
A.发生电化学腐蚀,铜为负极,铜极产生H2
B.铜易被腐蚀,铜极上发生还原反应,吸收O2
C.铁易被腐蚀,铁发生氧化反应,Fe-2e===Fe2+
D.发生化学腐蚀:Fe+Cu2+===Cu+Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
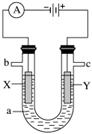
(1)若X、Y是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞,则:
①电解池中X极上的电极反应式是____________________________________________,
在X极附近观察到的现象是_________________________________________________。
②Y电极上的电极反应式是_______________________________________,
检验该电极反应产物的方法是____________________________________________。
(2)若用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是________________________________________,
电极反应式是__________________________________________。
②Y电极的材料是__________________________________________,
电极反应式是________________________________________________
(说明:杂质发生的电极反应不必写出)。
③当电路中有0.04 mol电子通过时,阴极增重_____________________________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下面列举了一些化学键的键能数据,供计算使用。
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
工业上的高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)===Si(s)+4HCl(g),该反应的反应热ΔH为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
两个有联系的不同反应相比
C(s)+O2(g)===CO2(g) ΔH1<0
C(s)+ O2(g)===CO(g) ΔH2<0
O2(g)===CO(g) ΔH2<0
则ΔH1____ΔH2。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com