
| A. | 100mL 0.5 mol/L MgCl2溶液 | B. | 200mL 0.25 mol/L KCl溶液 | ||
| C. | 100mL 0.5 mol/L HCl溶液 | D. | 100mL 0.5 mol/L NaClO溶液 |
分析 0.5mol/L NaCl溶液中的Cl-的物质的量浓度为0.5mol/L,结合选项中溶质的浓度及物质构成计算.
解答 解:A.100mL 0.5 mol/L MgCl2溶液中的Cl-的物质的量浓度为0.5mol/L×2=1mol/L,故A不选;
B.200mL 0.25 mol/L KCl溶液中的Cl-的物质的量浓度为0.25mol/L,故B不选;
C.100mL 0.5 mol/L HCl溶液中的Cl-的物质的量浓度为0.5mol/L,故C选;
D.0.5 mol/L NaClO溶液中不含氯离子,故D不选;
故选C.
点评 本题考查物质的浓度的计算,为高频考点,把握物质的构成及离子浓度的计算为解答的关键,侧重分析与计算能力的考查,注意选项D为易错点,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ①②③ | C. | ②③⑤ | D. | ①②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
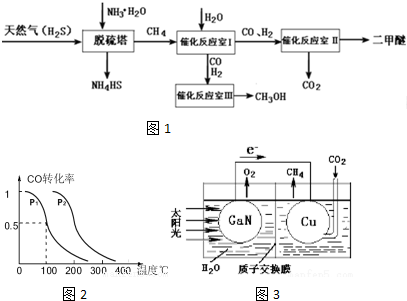
 甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇.
甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8 L 0.2mol/L的Na2SO4溶液 | B. | 8 L0.15mol/L的Na3PO4溶液 | ||
| C. | 10 L0.1 mol/L的Na2CO3溶液 | D. | 2 L 0.5mol/L的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法正确的是
①将1mol氯气通入足量水中发生反应转移电子数为NA
②12.0g熔融的NaHSO4中含有的阳离子数为0.1NA
③在标准状况下,22.4L HF中的氟原子数为NA
④17g羟基中含有的电子数为10NA
⑤1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA
⑥200mL1mol/LFe2 (SO4) 3溶液中,Fe3+和SO42-离子数的总和小于NA
A.①②⑤ B.①④⑥ C.②③⑥ D.②⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com