
| 正极 | 负极 | 电解质溶液 | |
| A | Cu | Zn | HCl |
| B | Zn | Cu | CuSO4 |
| C | Cu | Zn | CuCl2 |
| D | Zn | Cu | H2SO4 |
| A. | A | B. | B | C. | C | D. | D |
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案科目:高中化学 来源: 题型:解答题
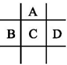
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
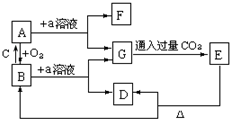 A是一种常见的半导体材料,E是一种白色沉淀.存在下列物质转化关系,据此填写下列空白.
A是一种常见的半导体材料,E是一种白色沉淀.存在下列物质转化关系,据此填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO与H2O反应 | B. | CH4在O2中燃烧 | ||
| C. | NaOH溶液与H2SO4溶液反应 | D. | Ba(OH)2•8H2O晶体与NH4Cl晶体反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(O2)=0.01mol/(L•s) | B. | v(NO)=0.008mol/(L•s) | ||
| C. | v(H2O)=0.001mol/(L•s) | D. | v(NH3)=0.002mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:
键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com