
下列有关说法正确的是( )
A. 含有共价键的化合物一定是共价化合物
B. 分子中只有共价键的物质一定是共价化合物
C. 非金属元素不能组成离子化合物
D. 含有离子键的化合物一定是离子化合物
科目:高中化学 来源: 题型:
将11.9 g由Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7 g。另取等质量的合金溶于过量稀硝酸中,生成了6.72 L NO(标准状况下),向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀的质量为( )
A.22.1 g B.27.2 g C.30 g D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,
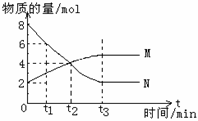 下列表述正确的是
下列表述正确的是
A.t3时,反应达到最大限度
B.t2时,正、逆反应速率相等,达到平衡
C.反应的化学方程式: N  2M
2M
D.t1时N的浓度是M浓度的4倍
查看答案和解析>>
科目:高中化学 来源: 题型:
在4L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)  2C(g)+xD(g),经过10s达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
2C(g)+xD(g),经过10s达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
A.x=1 B.B的转化率为20%
C.以C来表示反应的平均速率为0.2 mol·S-1·L-1
D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室可用环己醇(沸点:160.84℃,微溶于水)制备环己酮(沸点:155.6℃,微
溶于水),使用的氧化剂可以是次氯酸钠、重铬酸钾等。

下列装置分别是产品的合成装置和精制装置示意图:
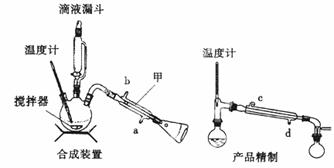
合成实验过程如下:
向装有搅拌器、滴液漏斗和温度计的三颈烧瓶中依次加入5.2 mL环己醇和25 mL冰醋酸。开动搅拌器,将40 mL次氯酸钠溶液逐渐加入到反应瓶中,并使瓶内温度维持在30~35℃,用磁性搅拌器搅拌5 min。然后,在室温下继续搅拌30 min后,在合成装置中再加入30 mL水、3g氯化铝和几粒沸石,加热蒸馏至馏出液无油珠滴出为止。
回答下列问题:
(1)在合成装置中,甲装置的名称是 。
(2)三颈烧瓶的容量为 (填“50 mL"、“100 mL”或“250 mL")。
(3)滴液漏斗右边的玻璃导管的主要作用是____________________ 。
(4)蒸馏完成后,向馏出液中分批加入无水碳酸钠至反应液呈中性为止,其目的是
__________________________________________________________________________;
然后加入精制食盐使之变成饱和溶液,将混合液倒人____ 中,分离得到有机层。
(5)用如上右图对粗产品进行精制,蒸馏收集____ ℃的馏分。
(6)检验坏己酮是否纯净,可使用的试剂为____ 。
A.重铬酸钾溶液 B.金属钠 C.新制的氢氧化铜悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
为了检验溴乙烷中含有溴元素,有以下操作,顺序合理的是 ( )
①加AgNO3溶液 ②加NaOH溶液 ③加热 ④加蒸馏水 ⑤加硝酸至溶液显酸性
A.②①③⑤ B.②④⑤③ C.②③⑤① D.②①⑤③
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,科学家已成功合成了少量N4,有关N4的说法正确的是( )
A.N4与N2互为同素异形体
B.N4与N2互为同位素
C.相同质量的N4和N2含原子个数比为1∶2
D.N4的摩尔质量是56 g
查看答案和解析>>
科目:高中化学 来源: 题型:
复方过氧化氢消毒剂具有高效、环保、无刺激无残留,其主要成分H2O2。
(1)H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了甲、乙两种实验装置。
若利用甲实验,可通过观察________现象,从而定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是________;若利用乙实验可进行定量分析,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是________。
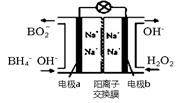 (2)在含有表面活性剂的酸性水溶液中,以碳为电极,通直流电进行电解可制取氢气和过氧化氢,过氧化氢在 (填“阴极”、“阳极”)产生。
(2)在含有表面活性剂的酸性水溶液中,以碳为电极,通直流电进行电解可制取氢气和过氧化氢,过氧化氢在 (填“阴极”、“阳极”)产生。
以H2O2和硼氢化合物NaBH4(B的化合价为+3价)作原料的燃料电池,可用作通信卫星电源。其工作原理如图所示,写出a极上的电极反应式: ,正极材料采用MnO2,MnO2除了作电极材料之外还可能具有的作用为
(3)锗(Ge)与碳是同主族元素,最新研究表明有机锗具有明显的抗肿瘤活性,锗不与NaOH 溶液反应,但在有H2O2存在时可与NaOH 溶液反应生成锗酸盐,其化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
现使用酸碱中和滴定法测定市售白醋(CH3COOH)的总酸量(g/100mL)
I 实验步骤:
(1)量取10.00mL食用白醋,用水稀释后转移到100mL_________________(填仪器名称)中定容,摇匀即得待测白醋溶液 高 考 资 源 网
(2)用酸式滴定管量取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2~3滴酚酞作指示剂
(3)用0.100mol/L NaOH溶液进行滴定。当______________________________________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次
II 实验记录:
| 滴 定 次 数 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)消耗/mL | 15.95 | 15.00 | 15.05 | 14.95 |
III 数据处理与讨论:
(1)甲同学在处理数据时计算:平均消耗NaOH溶液的体积
V=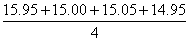 = 15.24mL ;指出他的计算的不合理之处:_________
= 15.24mL ;指出他的计算的不合理之处:_________
_____________________________________________________________;按正确数据处理,可得市售白醋总酸量为____________________g/100mL
(2)在实验滴定过程中,下列操作会使实验结果偏大的是______________(填序号)
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再用少量水洗涤内壁
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com