
【题目】液氨和水类似,也能电离:NH3+NH3![]() NH4++NH2-,25℃时,其离子积K=1.0×10-30。现将2.3g金属钠投入1.0L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中粒子关系不正确的是(设温度保持不变,溶液体积为1L)
NH4++NH2-,25℃时,其离子积K=1.0×10-30。现将2.3g金属钠投入1.0L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中粒子关系不正确的是(设温度保持不变,溶液体积为1L)
A. c(NH4+)=1.0×10-29molL-1 B. c(Na+)=c(NH2-)
C. c(NH2-)>c(NH4+) D. c(NH4+) c(NH2-)=1.0×10-30
【答案】B
【解析】A、2.3g金属钠投入1.0L液氨中发生反应为:2Na+2NH3=2NaNH2+H2↑,促进液氨的电离,c(NH4+) c(NH2-)=l.0×l0-30;反应生成NH2-物质的量为0.1mol,浓度为0.1mol/L,所以所得溶液中NH4+的浓度l.0×l0-29mol/L,选项A正确;B、溶液中电荷守恒,所以c(Na+)+c(NH4+)=c(NH2-),选项B不正确;C、c(NH2-)=0.1mol/L,c(NH4+)=l.0×l0-29mol/L,所以c(NH2-)>c(NH4+),选项C正确; D、离子积常数只与温度有关,温度不变,离子积常数不变,K= c(NH4+) c(NH2-)=1.0×10-30,选项D正确。答案选B。


科目:高中化学 来源: 题型:
【题目】水合碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O],又称轻质碳酸镁。常利用菱镁矿(质量含量为碳酸镁90%,碳酸钙10%)碳化法制取:
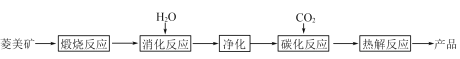
(1)根据下列表格数据,选择消化反应的最佳温度__________;理由是___________________________。
消化温度/℃ | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
转化率/% | 50.3 | 58.2 | 85.1 | 85.2 | 90.7 | 91.2 | 91.5 |
(2)碳化反应可生成Mg(HCO3)2,生成Mg(HCO3)2的化学方程式为____________。
(3)流程图中__________和__________可以为碳化反应提供二氧化碳源。
(4)有工艺设计利用卤水碳化法制取轻质碳酸镁:
①卤水中含有Fe2+和Mn2+,当其浓度小于1×10-5mol·L-1时,可以认为完全除去。常温时当调节溶液PH为9.5时,此时Mn2+小于__________mol·L-1,不会沉淀出来。
物质 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
Ksp | 10-11 | 10-39 | 10-17 | 10-14 |
②如果把Fe2+转化为Fe3+,从环境角度选择最合适的氧化剂为__________。
A.Ca(ClO)2 B.Cl2 C.H2O2 D.HNO3
③下列方案中,较好的为__________,理由是______________________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产中具有重要作用。
(1)某小组进行工业合成氨N2(g)+3H2(g)![]() 2NH3(g) △H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
2NH3(g) △H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。

实验②从开始到达到平衡状态的过程中,用H2表示的平均反应速率为 。与实验①相比,.实验②所采用的实验条件可能为 (填字母),实验③所采用的实验条件可能为 (填字母)。
a.增大压强b.减小压强c.升高温度d.降低温度e.使用催化剂
(2)NH3可用于处理废气中的氮氧化物,其反应原理为2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g) △H<0欲提高废气中氮氧化物的转化率,可采取的措施是 (填字母)
2N2(g)+3H2O(g) △H<0欲提高废气中氮氧化物的转化率,可采取的措施是 (填字母)
a.升高温度 b.增大压强 c,增大NH3的浓度
(3)NCl3遇水发生水解反应,生成NH3的同时得到 (填化学式)。ClO2是广谱高效消毒剂,制备原理为NCl3+6ClO2-+3H2O=NH3↑+6ClO2+3OH-+3Cl-。若转移1mol电子,则制取ClO2的质量为 。
(4)25℃时,将amol·L-1的氨水与bmol·L-1盐酸等体积混合,反应后溶液恰好显中性,则a b(填“>”、“<”或“=”)。用a、b表示NH3·H2O的电离平衡常数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s) ![]() C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
①容器内温度不变 ②混合气体的密度不变 ③混合气体的压强不变
④混合气体的平均相对分子质量不变 ⑤C(g)的物质的量浓度不变
⑥容器内A、C、D三种气体的浓度之比为2:1:1 ⑦某时刻v(A)=2v(C)且不等于零
⑧单位时间内生成n mol D,同时生成2n mol A
A. 4 B. 5 C. 6 D. 7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A. 向0.1 molL-1CH3COOH溶液中加入少量水,溶液中 减小
减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中  增大
增大
C. 向盐酸中加入氨水至中性,溶液中 >1
>1
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3溶液中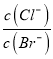 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】野外被蚊虫叮咬会出现红肿,这是由甲酸(HCOOH)造成的。请完成下列探究。
I . HCOOH 酸性探究
(1)下列酸属于二元酸的有___________。
a.HCOOH b.H2CO3 c.H2C2O4 d.CH3CHOHCH2COOH
(2)下列实验事实能证明甲酸为弱酸的是___________。
a.HCOONH4溶液呈酸性
b.将甲酸滴入![]() 溶液中有气体生成
溶液中有气体生成
C.常温下,0.1mol·L-1的甲酸溶液的pH约为3
d.等浓度的盐酸与甲酸溶液。前者的导电能力更强
(3)可用小苏打溶液处理蚊虫叮咬造成的红肿,请用离子方程式表示其原理_________。
Ⅱ甲酸制备甲酸铜探究
相关原理和化学方程式如下:
先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后碱式碳酸铜再与甲酸反应制得四水甲酸铜![]() 晶体:
晶体:
![]()
![]()
实验步骤如下:
(4)碱式碳酸铜的制备:
![]()
①步骤ⅰ是将一定量![]() 晶体和
晶体和![]() 固体一起放到研钵中研细并混合均匀。
固体一起放到研钵中研细并混合均匀。
②步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃-80℃,温度不能过高的原因是________________________________。
③步骤ⅱ的后续操作有过滤、洗涤等。检验沉淀是否已洗涤干净的方法为________。
(5)甲酸铜晶体的制备:
将Cu(OH)2CuCO3固体放入烧杯中,加入一定量的热蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质。在通风橱中蒸发滤液至原体积的三分之一时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体 2~3 次,晾干,得到产品。
①“趁热过滤”中,必须“趁热”的原因是_________________。
②用乙醇洗涤晶体的目的是________________________________。
③若该实验所取原料 CuSO45H2O 晶体和 NaHCO3 固体的质量分别为12.5 g 和9.5 g,实验结 束后,最终称量所得的产品为 7.91 g,则产率为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关分子结构如图所示,下列叙述中,正确的是 ( )
![]()
A. 除苯环外的其余碳原子有可能都在一条直线上
B. 所有的原子都在同一平面上
C. 12个碳原子不可能都在同一平面上
D. 12个碳原子有可能都在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表中的一部分,根据A-I在周期表中的位置,第(2) ~ (3)小题用元素符号或化学式回答,(4)~(6)小题按题目要求回答。
族 周期 | I A | Ⅱ A | Ⅲ A | Ⅳ A | Ⅴ A | Ⅵ A | Ⅶ A | O |
1 | A | |||||||
2 | D | E | G | |||||
3 | B | C | F | H | I |
(1)表中元素,化学性质最不活泼的原子结构示意图是___________,非金属性最强的元素在周期表中的位置是__________________________,
(2)最高价氧化物的水化物中碱性最强的是_________,酸性最强的是___________,
(3)A分别与D、E、G形成的最简单化合物中,最不稳定的_______________,
(4)A和E组成最简单化合物的电子______________
(5)在B、C、F、G的简单离子中,离子半径由大到小的顺序是__________________,
(6)由A的单质与O2构成的燃料电池中,在E的最高价氧化物对应水化物的条件下进行,写出正极的电极反应式______________________________________。
(7)当B的最高价氧化物的水化物与C的最高价氧化物反应后,向所得溶液中通入过量D的最高价氧化物的离子方程式___________________________________,
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com