
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
分析 同温同压下,由C、H、O组成的有机物X的蒸汽相对氢气的密度为51,则X的相对分子质量为51×2=102,X中氧元素的质量分数为31.4%,则分子中N(O)=$\frac{102×31.4%}{16}$=2,分子中碳、氢元素的原子量之和为102-16×2=70,利用余商法$\frac{70}{14}$=5…0,所以分子式为C5H10O2,可能是酸、也可能是酯,但能在酸性条件下发生水解反应只能是酯,从而判断同分异构体;
解答 解:同温同压下,由C、H、O组成的有机物X的蒸汽相对氢气的密度为51,则X的相对分子质量为51×2=102,X中氧元素的质量分数为31.4%,则分子中N(O)=$\frac{102×31.4%}{16}$=2,分子中碳、氢元素的原子量之和为102-16×2=70,利用余商法$\frac{70}{14}$=5…0,所以分子式为C5H10O2,可能是酸、也可能是酯,但能在酸性条件下发生水解反应只能是酯,属于饱和一元酯,
若为甲酸和丁醇酯化,丁醇有4种,可形成4种酯;
若为乙酸和丙醇酯化,丙醇有2种,可形成2种酯;
若为丙酸和乙醇酯化,丙酸有1种,可形成1种酯;
若为丁酸和甲醇酯化,丁酸有2种,可形成2种酯;
所以能在酸性条件下发生水解反应的X的同分异构体有9种酯;
故选C.
点评 本题考查有机物分子式的确定、同分异构体书写、官能团的性质等,计算确定有机物的分子式、确定酯的种类是解题的关键,注意掌握官能团的性质.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | X与Y形成的化合物只有一种 | |
| B. | 原子半径的大小顺序:r(R)>r(W)>r(Y) | |
| C. | 元素R的简单气态氢化物的热稳定性比W的强 | |
| D. | Y的最高价氧化物对应水化物的酸性比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
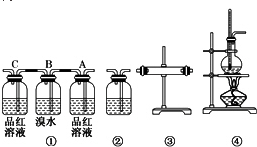
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活化能的大小对化学反应前后的能量变化不产生影响 | |
| B. | 化学键的断裂和形成是物质在化学变化中发生能量变化的主要原因 | |
| C. | 盐酸和NaOH(aq)反应的中和热△H=-57.3kJ/mol,则H2SO4(aq)和Ca(OH)2(aq)反应的中和热△H=2×(-57.3)kJ/mol | |
| D. | CO(g)的燃烧热是283.0kJ/mol,则反应2CO2(g)=2CO(g)+O2(g)的反应热△H=+2 x283.0kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
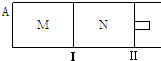
| A. | 若x=2,达到平衡后B 的体积分数关系为:φ(M)>φ(N) | |
| B. | 若x<2,达到平衡后B的转化率关系为:α(M)>α(N) | |
| C. | 若x>2,C的平衡物质的量浓度关系为:c(M)>c(N) | |
| D. | x不论为何值,起始时向N容器中充入任意值的A,平衡后N容器中B的浓度均相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
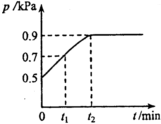 在1.0L密闭容器中放入0.10mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析不正确的是( )
在1.0L密闭容器中放入0.10mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析不正确的是( )| A. | 从反应开始到t1时的平均反应速率v(X)=$\frac{0.04}{{t}_{1}}$mol(L•min) | |
| B. | 该温度下此反应的平衡常数K=$\frac{0.32}{{t}_{2}}$ | |
| C. | 欲提高平衡体系中Y的含量,可降低体系温度或减少Z的量 | |
| D. | 其他条件不变,再充入0.10 mol气体X,平衡正向移动,X的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com