
| A.①=②=③ | B.①>②=③ |
| C.①<②=③ | D.①<②<③ |
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.①② | B.①③ | C.③④ | D.②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞; |
| B.用标准溶液润洗滴定管2~3次; |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液; |
| D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3 mL; |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
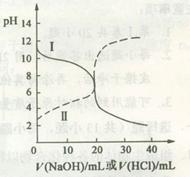
| A.曲线I中滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B.曲线I中滴加溶液到25 mL时:c(NH4+)>c(C1-)>c(H+)>c(OH-) |
| C.曲线II中滴加溶液在10 mL~25 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| D.曲线II中滴加溶液到10mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.b>a=d>c | B.a=b>c>d |
| C.a=b>d>c | D.c>a=d>b |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向水中投入一小块金属钠 | B.将水加热煮沸 |
| C.向水中通入CO2气体 | D.向水中加食盐晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
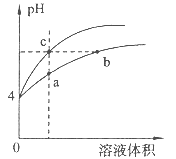
| A.a、c两点溶液的导电能力相同 |
| B.b点溶液中c(H+)+c(NH3·H2O)=c(OH-) |
| C.a、b、c三点溶液中水的电离程度a>b>c |
| D.用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb=Vc |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com