
【题目】在某密闭容器中加入HBr,在一定条件下发生反应∶2HBr(g)![]() Br2(g)+H2(g), c(HBr)随反应时间的变化如曲线①所示,分别改变一个条件,得到曲线②、③,下列说法正确的是( )
Br2(g)+H2(g), c(HBr)随反应时间的变化如曲线①所示,分别改变一个条件,得到曲线②、③,下列说法正确的是( )
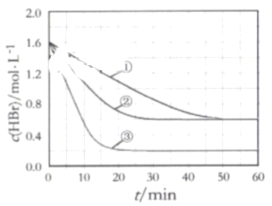
A.该反应正反应为放热反应
B.曲线①,0~ 50 min用H2表示的平均反应速率为0.02 mol﹒L-1﹒min-1
C.曲线②,可能使用了催化剂或增大了压强
D.曲线③达到平衡时,往容器中加入浓度均为0.2 mol﹒L-1的三种物质,平衡将向正反应方向移动
【答案】D
【解析】
分别改变一个条件,得到曲线②、③。从曲线①得到曲线②,既加快速率平衡又不移动,只能使用催化剂,从曲线①得到曲线③,意味着反应速率加快但平衡右移了,则改变的另一个条件只能是升温,据此回答;
A. 按分析,升温平衡右移,则该反应正反应为吸热反应,A错误;
B. 曲线①,0~ 50 min用HBr表示的平均反应速率为![]() =0.02mol﹒L-1﹒min-1,根据速率之比和系数成正比可知,用H2表示的平均反应速率为=0.01 mol﹒L-1﹒min-1,B错误;
=0.02mol﹒L-1﹒min-1,根据速率之比和系数成正比可知,用H2表示的平均反应速率为=0.01 mol﹒L-1﹒min-1,B错误;
C. 曲线②,可能使用了催化剂,速率加快,平衡不动,各物质浓度不变;如果增大压强,通过缩小体积,气体浓度都增大了,而实际上HBr浓度减小了,与图像变化不符合,C错误;
D. 曲线③达到平衡时, ,得
,得![]() ,往容器中加入浓度均为0.2 mol﹒L-1的三种物质,得
,往容器中加入浓度均为0.2 mol﹒L-1的三种物质,得![]() ,则QC<K,平衡将向正反应方向移动,D正确;
,则QC<K,平衡将向正反应方向移动,D正确;
答案选D。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】已知电解质溶液电导率越大导电能力越强。常温下用![]() 溶液分别滴定
溶液分别滴定![]() 浓度均为
浓度均为![]() 的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法错误的是( )。
的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法错误的是( )。
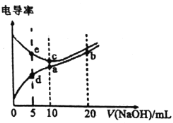
A.c点的混合液pH=7
B.e、d两点溶液混合后的溶液中:![]()
C.b点溶液中:![]()
D.a、b、c三点溶液中水的电离程度:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是( )
2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是( )

A. 维持温度、容积不变,t1时充入SO3(g)
B. 维持压强不变,t1时升高反应体系温度
C. 维持温度、容积不变,t1时充入一定量Ar
D. 维持温度、压强不变,t1时充入SO3(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图所示),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升,根据实验现象判断下列说法错误的是( )

A.实验中发生的反应都是氧化还原反应
B.铝是一种较活泼的金属
C.铝与氧气反应放出大量的热量
D.铝片上生成的白毛是氧化铝和氧化汞的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在杠杆的两端分别挂着质量、体积都相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在稀硫酸和硫酸铜溶液中片刻,如图所示,则下列说法正确的是( )
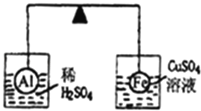
A.铝球一定是空心的
B.左边烧杯中的溶液质量减少了
C.去掉两烧杯杠杆仍平衡
D.右边铁球上出现红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇与水蒸气重整可获得清洁能源,在催化剂作用下发生如下两步反应∶
反应①∶CH3OH(g)==CO(g)+2H2(g) △H1
反应②∶CO(g) + H2O(g)==CO2(g)+H2(g) △H2
根据能量变化示意图,下列说法不正确的是( )
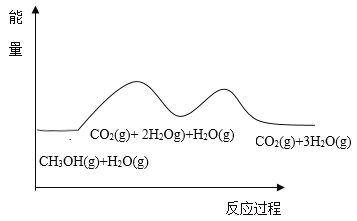
A.总反应的热化学方程式为∶ CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ![]()
B.1mol CO(g)和1mol H2O(g)的总键能大于lmol CO2(g)和1mol H2(g)的总键能
C.甲醇与水蒸气催化重整的总反应速率取决于反应①
D.催化剂在反应中改变了活化能,加快了反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用饱和电解食盐水来制取氯气.现取500mL含NaCl为11.7g的饱和食盐水进行电解.(已知2Cl-+2H2O ![]() Cl2↑+ H2↑+ 2OH-)
Cl2↑+ H2↑+ 2OH-)
(1) 在标准状况下制得Cl2多少升?
(2) 所得NaOH的物质的量浓度为多少?(电解前后溶液体积保持不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列反应的离子方程式:
①硫酸和氢氧化钠溶液反应___;
②少量二氧化碳通入澄清石灰水___;
③碳酸钙和盐酸反应___;
④氯化钠和硝酸银反应___。
(2)写出符合下列离子反应的化学方程式:
①CO32-+Ba2+=BaCO3↓___;
②Cu2++Fe=Cu+Fe2+___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用难挥发性酸制备易挥发性酸的原理,用浓硫酸与硝石(NaNO3)反应制备HNO3,反应装置如图,下列说法不正确的是

A.反应温度如果过高,制得HNO3可能会呈现黄色
B.反应方程式为:NaNO3 + H2SO4(浓)![]() NaHSO4 + HNO3↑
NaHSO4 + HNO3↑
C.可从实验室中选无色透明洁净的试剂瓶盛装制得的硝酸
D.曲颈甑不适宜制备沸点过低的物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com