
【题目】有如图所示的离子晶体空间结构示意图。

(1)以M代表阳离子,以N代表阴离子,写出各离子晶体的组成表达式:A________,B________,C_________,D________。
(2)已知FeS2晶体(黄铁矿的主要成分)具有A的空间结构。
①FeS2晶体中存在的化学键类型是 ________。
②若晶体结构A中相邻的阴、阳离子的最小距离为a cm,且用NA代表阿伏加德罗常数,则FeS2晶体的密度是________g/cm3。
【答案】MN MN2 MN3 MN 离子键 非极性共价键②60/a3NA
【解析】
根据晶体的空间结构示意图,结合“心一、面二、棱四、角八”的规律计算阴、阳离子个数比,从而得出晶体表达式。先依据立方体内阴、阳离子个数和摩尔质量可求出m,然后利用阴、阳离子间的距离求体积,从而得出密度。
对于A,阴离子位于立方体的四个顶点,因此阴离子在该立方体内只有4![]() =
=![]() (个),同理阳离子也有
(个),同理阳离子也有![]() (个),组成上为
(个),组成上为![]() :
:![]() ,表达式为MN;对于B,阴离子在立方体内有4
,表达式为MN;对于B,阴离子在立方体内有4![]() +2=4(个),阳离子在立方体内有8
+2=4(个),阳离子在立方体内有8![]() +1=2(个),组成为MN2;对于C阴离子在立方体内有4
+1=2(个),组成为MN2;对于C阴离子在立方体内有4![]() +1=
+1=![]() (个),阳离子在立方体内有4
(个),阳离子在立方体内有4![]() =
=![]() (个),组成为MN3 ;对于D,阴离子在立方体内有1个,阳离子在立方体内有8
(个),组成为MN3 ;对于D,阴离子在立方体内有1个,阳离子在立方体内有8![]() =1(个),组成为MN。
=1(个),组成为MN。
FeS2晶体中存在的化学键为离子键和非极性共价键(S-S)。因密度ρ=![]() ,晶胞内阴、阳离子个数分别为0.5,由二硫化亚铁的摩尔质量可求出一个晶胞的质量为60g/NA.晶胞的边长即阴、阳离子的最短距离,则晶胞的体积为a3cm3,则晶体的密度ρ=60/a3NAg/cm3。
,晶胞内阴、阳离子个数分别为0.5,由二硫化亚铁的摩尔质量可求出一个晶胞的质量为60g/NA.晶胞的边长即阴、阳离子的最短距离,则晶胞的体积为a3cm3,则晶体的密度ρ=60/a3NAg/cm3。


科目:高中化学 来源: 题型:
【题目】已知Ca3(PO4)2与SiO2、C高温共热可以反应得到CaSiO3、P4蒸气和CO.反应如下:Ca3(PO4)2+SiO2+C![]() CaSiO3+P4↑+CO↑
CaSiO3+P4↑+CO↑
(1)配平该反应方程式,并标出电子转移方向和数目____________.
_____Ca3(PO4)2+_____SiO2+_____C![]() _____CaSiO3+_____P4↑+_____CO↑
_____CaSiO3+_____P4↑+_____CO↑
(2)该反应中被还原的元素是_____,氧化产物是_____.
(3)每消耗24.0g碳时,有_____个电子发生转移,生成P4_____g.
(4)反应所得混合气体,折算成标况下,其气体密度为_____g/L(保留两位小数).与该反应中涉及到的磷元素相同主族的氮元素,是造成水体富营养化的主要原因.若某污水中NH4Cl含量为180mg/L.
(5)写出NH4Cl的电子式_____.
(6)为除去废水中的NH4+,向103L该污水中加入0.1mol/LNaOH溶液,发生如下反应:NH4++OH﹣→NH3+H2O.则理论上需要NaOH溶液的体积为_____L(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将SO2通入蒸馏水中模拟酸雨形成过程,实验数据如图。已知Ka1(H2SO3)=10-2,Ka2(H2SO3)=10-7。下列说法不正确的是

A. 300s未通O2时溶液中c(H2SO3)=10 -5.46mol·L-1
B. 400s时溶液中c(HSO3-)+c(SO32-)+c(SO42-)+c(H2SO3)≈10-3.73mol·L-1
C. 600s时,溶液中c(H+)约为c(SO42-)2倍
D. 由图推知,H2O2氧化性大于O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物所含的官能团种类和结构会决定有机物的性质。
(1)多巴胺是一种神经传导物质,可影响人的情绪,其结构简式如图所示。

①多巴胺分子中官能团的名称为_____(填两种)。
②1 mol多巴胺最多可以消耗_____mol溴水中的Br2。
③多巴胺分子通常需要密封保存,其原因是_____。
(2)化合物D是合成一种心脏病药物的中间体,合成它的路线如下:
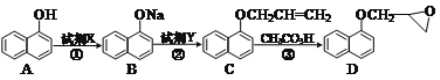
①A分子中含_____种化学环境不同的氢。试剂X的化学式可以是_____。化合物D中含氧官能团的名称为_____。
②试剂Y的分子式为C3H5Cl,其结构简式为_____。
③化合物E是A的一种同分异构体,其分子中含有苯环,能发生银镜反应,能与溴水发生加成反应,分子中有4种不同化学环境的氢原子。任写一种符合条件的化合物E的结构简式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】衣康酸二甲酯常用于润滑油增稠剂、共聚物乳胶、改性醇酸树脂等。由3-甲基-3-丁烯酸合成衣康酸二甲酯的路线如下所示:

回答下列问题:
(1)B中的含氧官能团的名称是______________________,康酸的分子式为___________。
(2)反应①、⑤的反应类型分别是__________、____________,反应④所需的反应条件为___________。
(3)反应⑤的化学方程式为_________________________________。
(4)衣康酸的同分异构体中,含有碳碳双键,与NaHCO3溶液产生气体,且能发生银镜反应和水解反应的有__种。
(5)![]() 和苯甲醇可合成
和苯甲醇可合成 将以下合成路线补充完整(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂条件) ______________。
将以下合成路线补充完整(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂条件) ______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某课外小组制取乙炔并测定乙炔的某些性质的实验.

(1)写出实验室制取乙炔的化学方程式: ______.
(2)实验室制取乙炔时,分液漏斗中的液体 a通常是 ______.
(3)B溶液的作用是 ______.
(4)装置D中的现象是: ______.
(5)乙炔能否使溴的的四氯化碳溶液褪色?______(“能”或“不能”),若能写出完全反应原理_______________
(6)工业上常用乙炔、氯化氢等物质作原料来合成聚氯乙烯,请写出相关方程式 _______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如下图所示。据图判断错误的是( )

A. a的数值一定大于9
B. Ⅱ为氨水稀释时溶液的pH变化曲线
C. 稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大
D. 完全中和相同体积的两溶液时,消耗相同浓度的稀硫酸的体积:V(NaOH)<V(氨水)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com