
| 元素编号 | 元素特征信息 |
| A | 是原子半径最小的元素 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 是短周期元素中原子半径最大的主族元素. |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
| F | 原子有三个电子层,且最外层电子数是最内层电子数的3倍, |
 ;
;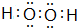 .
.分析 A、B、C、D、E短周期五种元素.A是原子半径最小的元素,则A为氢元素;B的阴离子带两个单位的负电荷,单质是空气主要成分之一,则B为氧元素;C是短周期元素中原子半径最大的主族元素,则C为Na;D的氢氧化物和氧化物都有两性,且与C(钠)同周期,故D为Al;E与C(Na)同周期,原子半径在该周期最小,则E为Cl;F原子有三个电子层,且最外层电子数是最内层电子数的3倍,最外层电子数为6,故F为S元素.
解答 解:A、B、C、D、E短周期五种元素.A是原子半径最小的元素,则A为氢元素;B的阴离子带两个单位的负电荷,单质是空气主要成分之一,则B为氧元素;C是短周期元素中原子半径最大的主族元素,则C为Na;D的氢氧化物和氧化物都有两性,且与C(钠)同周期,故D为Al;E与C(Na)同周期,原子半径在该周期最小,则E为Cl;F原子有三个电子层,且最外层电子数是最内层电子数的3倍,最外层电子数为6,故F为S元素.
(1)B为O元素,E为Cl元素,故答案为:O;Cl;
(2)C与B 形成的两种离子化合物为Na2O、Na2O2,故答案为:Na2O、Na2O2;
(3)B与A 形成的两种化合物为H2O、H2O2,电子式分别为 、
、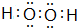 ,
,
故答案为: 、
、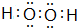 ;
;
(4)含O、Na、S三种元素的化合物有Na2SO4、Na2SO3,故答案为:Na2SO4、Na2SO3;
(5)Al和氢氧化钠溶液反应的离子方程式:2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(6)SO2和氯气在水溶液中反应的化学方程式是:SO2+Cl2+2H2O=2HCl+H2SO4,
故答案为:SO2+Cl2+2H2O=2HCl+H2SO4;
(7)Al和氧化铁反应的化学方程式:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,属于放热反应,
故答案为:放热;2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
点评 本题以元素推断为载体,考查元素化合物性质、原子结构位置与周期律关系、化学用语,难度不大,注意基础知识的理解掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③⑤ | C. | ①②⑤ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
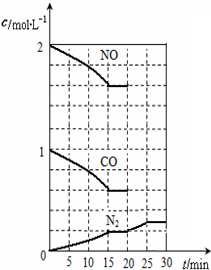 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1盐酸的澄清透明溶液:Fe3+、Na+、SO42-、Br- | |
| B. | pH=1的溶液中:Na+、K+、MnO4-、HCO3- | |
| C. | 能使石蕊变红的溶液:Cu2+、Na+、AlO2-、Cl- | |
| D. | c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在中和滴定实验中,锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,须经干燥或润洗后方可使用 | |
| B. | 用碱式滴定管量取25.00mL高锰酸钾溶液 | |
| C. | 向冰醋酸中加水至配成醋酸稀溶液的过程中H+的浓度逐渐减小 | |
| D. | 25℃时NH4Cl溶液的KW大于100℃时NaCl溶液的KW |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
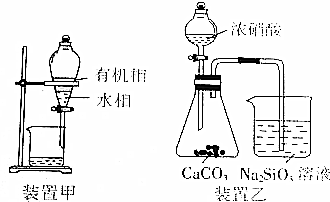
| A. | 制备Fe(OH)3胶体:向0.1mol•L-1FeCl3溶液中加适量NaOH溶液并煮沸片刻 | |
| B. | 用装置甲分液,放出水相后再从分液漏斗下口放出有机相 | |
| C. | 用装置乙进行实验,证明酸性:硝酸>碳酸>硅酸 | |
| D. | 探讨改变浓度研究反应“2Fe3++2I-?2Fe2++I2”中Fe3+和Fe2+的相互转化:向3mL 0.05mol•L-1Fe2(SO4)3溶液中加入3 mL 0.01mol•L-1 KI溶液,将所得黄色溶液等分成三份,第一份加入数滴0.01 mol•L-1AgNO3溶液,第二份加入1mL0.01mol•L-1FeSO4溶液,第三份加1mL水,观察并比较实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
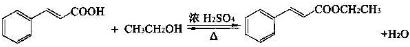
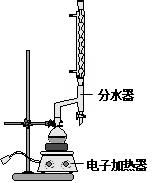
| 名称 | 相对分子质量 | 原色,状态 | 沸点(℃) | 密度(g•cm-3) |
| 肉桂酸 | 148 | 白色晶体 | 300 | 1.2475 |
| 肉桂酸乙酯 | 176 | 无色油状液体 | 271.5 | 1.0491 |
| 乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com