
| A. | 超级病菌NDM-l几乎对所有抗生素都具有抗药性,死亡率很高.为防止超级病菌的感染,要加强环境、个人的卫生和消毒,其中消毒剂常选用含氯消毒剂、双氧水、酒精等氧化性强的物质 | |
| B. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 | |
| C. | 漂白粉在空气中变质是因为CaCl2与空气中的CO2反应生成 CaCO3 | |
| D. | 用热的纯碱溶液洗去油污是因为Na2CO3可直接与油脂反应 |
分析 A.氯消毒剂、双氧水、酒精等能使超级病菌NDM-l发生变性,酒精不具有氧强化性;
B.依据铝合金具有质量轻,强度大,抗腐蚀能力比较强的优点解答;
C.漂白粉中次氯酸钙和空气中的二氧化碳水蒸气发生反应生成碳酸钙和次氯酸,次氯酸见光分解生成氧气和盐酸;
D.碳酸钠水解显碱性,可促进油污的水解.
解答 解:A.氯消毒剂、双氧水、酒精等能使超级病菌NDM-l发生变性,可以用来杀菌消毒,但是酒精不具有强氧化性,故A错误;
B.铝常温下能与空气中氧气反应,生成一层致密的氧化物保护膜,从而具有抗腐蚀性,铝合金材料的密度小,用以减轻列车质量,铝合金强度大,所以高铁车厢大部分材料采用铝合金,故B正确;
C.漂白粉在空气中久置变质,漂白粉中次氯酸钙和空气中的二氧化碳水蒸气发生反应生成碳酸钙和次氯酸,次氯酸见光分解生成氧气和盐酸,漂白粉失效,故C错误;
D.碳酸钠水解显碱性,油脂在碱性溶液中水解,所以热的纯碱可促进油污的水解,碳酸钠与油脂不反应,故D错误;
故选:B.
点评 本题考查了物质的性质与用途,明确蛋白质变性的方法、合金的性质及用途、漂白粉变质原理、油脂水解原理是解题关键,侧重考查学生分析、应用能力,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
 氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:
氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题: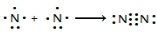 .
.| 化学键 | N-H | N-N | N═N | N≡N | O═O | O-H |
| 键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6gCH4中含有的分子数 | |
| B. | 100 mL1mol/LH2SO4中含有的H+ 数 | |
| C. | 2.4gMg中含有的原子数 | |
| D. | 标准状况下,22.4LCO气体中含有的分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与软脂酸属于同系物的最简单有机物是甲酸 | |
| B. | 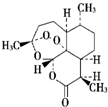 青蒿素是抗疟疾特效药,结构如图所示,有酯基、过氧键和醚键,不溶于水,易溶于氯仿、丙酮等,能够发生水解反应,具有强氧化性 | |
| C. | 油脂在一定条件下水解成高级脂肪酸和甘油,称为皂化反应 | |
| D. | 有X、Y两种有机物,不论何种比例混合,只要其物质的量之和不变,完全燃烧时耗氧气量和生成水的物质的量也不变,若X为CH4,则Y可以是CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
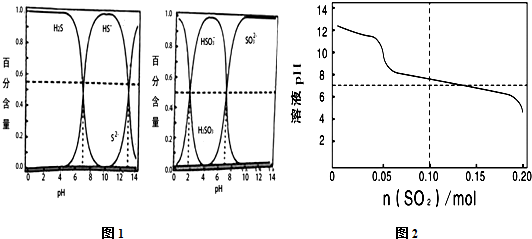
| A. | 由图1的一级电离与二级电离的Ka值可知H2SO3?2H++SO32- Ka≈10-7 | |
| B. | 向1L0.1 mol•L-1的Na2S溶液中持续通入SO2气体达到0.1 mol时,溶液中H2S、HS-、HSO3-、SO32-可同时一定量共存 | |
| C. | 向1L0.1 mol•L-1的Na2S溶液中持续通入SO2气体达到0.1 mol时,溶液中存在如下关系:c(H+)+c(Na+)═c(OH-)+2c(S2-)+2c(SO32-)+c(HS- )+c(HSO3-) | |
| D. | 在反应过程中当pH降至7.5左右,之后可能出现淡黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10m) | 0.37 | 1.86 | 1.43 | 0.99 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +1 | +3 | +7 | +5 | - |
| 最低负价 | -1 | - | - | -1 | -3 | -2 | |
| A. | 离子半径:Y>Z>M | |
| B. | Y、Z、M三种元素的最高价氧化物的水化物两两之间会反应 | |
| C. | 化合物XM、YM都是电解质.熔融状态下都能导电 | |
| D. | 元素Z、M、R的离子均能破坏水的电离平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CHO+H2$→_{△}^{催化剂}$CH3CH2OH | B. | CH2=CH2+HCl$\stackrel{一定条件}{→}$CH3CH2Cl | ||
| C. | 2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH | D. | 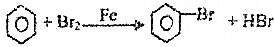 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
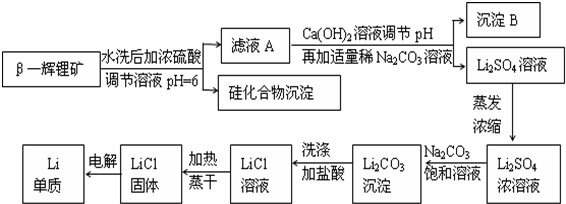
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com