
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色 气泡后,迅速停止 | Fe、Cu接触后,其表面 均产生红棕色气泡 |
下列说法中,不正确的是( )
A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化
【答案】C
【解析】
I 中铁和稀硝酸生成一氧化氮,一氧化氮遇空气生成二氧化氮;Ⅱ中Fe遇浓硝酸钝化,表面形成致密的氧化层,阻止Fe进一步反应,所以产生少量红棕色气泡后,迅速停止;Ⅲ中构成原电池,Fe作为负极,且Fe与浓硝酸直接接触,会产生少量二氧化氮,Cu作为正极,发生得电子的反应,生成二氧化氮。
A.I 中铁和稀硝酸生成一氧化氮,一氧化氮遇空气生成二氧化氮,化学方程式为: 2NO+O2=2NO2,A正确;
B.常温下,Fe遇浓硝酸易钝化,表面形成致密的氧化层,阻止Fe进一步反应,B正确;
C.对比Ⅰ、Ⅱ中现象,说明浓HNO3的氧化性强于稀HNO3,C错误;
D.Ⅲ中构成原电池,在Fe、 Cu之间连接电流计,可判断Fe是否持续被氧化,D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】利用微生物可实现苯酚(![]() )废水的净化,装置如图所示。下列有关说法正确的是
)废水的净化,装置如图所示。下列有关说法正确的是
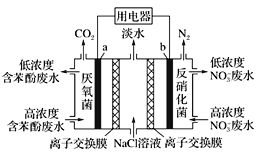
A. a极的电极反应式为:C6H5OH-28e-+11H2O=6CO2↑+28H+
B. b极为正极,发生氧化反应
C. 中间室的Na+向左室移动
D. 右室生成0.1 mol N2时,用电器流过0.5 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于化学反应:N2(g)+O2(g)![]() 2NO(g),在密闭容器中,下列条件的改变引起该反应的反应速率的变化是什么(填在横线上)。
2NO(g),在密闭容器中,下列条件的改变引起该反应的反应速率的变化是什么(填在横线上)。
A.缩小体积使压强增大______________________________________________________。
B.体积不变充入N2使压强增大________________________________________________。
C.体积不变充入氩气使压强增大_______________________________________________。
D.压强不变充入氩气使体积增大_______________________________________________。
E.增大体积使压强减小_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于工业合成氨反应N2+3H22NH3+Q(Q>0),下列判断正确的是( )
A.3体积![]() 和足量
和足量![]() 反应,必定生成2体积
反应,必定生成2体积![]()
B.使用合适的催化剂,可以提高提高原料的利用率
C.![]() 左右比室温更有利于向合成氨的方向进行
左右比室温更有利于向合成氨的方向进行
D.及时使氨液化、分离的主要目的是提高![]() 和
和![]() 的利用率
的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液,经测定含有Al3+、Br-、SO42-,且各离子物质的量浓度相等(不考虑水电离出来的H+和OH-),则对该溶液的说法合理的是( )
A.可能含有![]() B.可能含有
B.可能含有![]() C.一定含有
C.一定含有![]() D.至少含有四种离子
D.至少含有四种离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0.100 mol·L-1的NaOH溶液滴定10.00 mL浓度均为0.100 mol·L-1 的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. 曲线②代表滴定CH3COOH溶液的曲线
B. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.5 mol·L-1
C. 在相同温度下,A、B、C三点溶液中水的电离程度:B<A<C
D. D点溶液中:c(Cl-)=2c(OH-)-2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容下,将2mol气体A和2mol气体B通入体积为2L的密闭容器中,发生如下反应:2A(g)+B(g)![]() xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol/L。
xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol/L。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为__。
(2)x=__。
(3)下列各项可作为该反应达到平衡状态的标志是__(填字母)。
A.气体密度不再变化
B.压强不再变化
C.A的消耗速率与B的消耗速率之比为2:1
D.气体平均相对分子质量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的 A 置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:A(s)![]() 2B(g)+C(g)+D(g)。不能判断该分解 反应已经达到化学平衡状态的是
2B(g)+C(g)+D(g)。不能判断该分解 反应已经达到化学平衡状态的是
A.v 正(B)=2v 逆(C)B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变D.密闭容器中气体 B 的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了缓解温室效应,科学家提出了多种回收和利用CO2的方案。
方案I:利用FeO吸收CO2获得H2
i.6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △Hl=-76.0kJ/mol
ⅱ.C(s)+2H2O(g)==CO2(g)+2H2(g) △H2=+113.4kJ/mol (1)3FeO(s)+H2O(g)=Fe3O4(s)+H2(g) △H3=__________。
(2)在反应i中,每放出38.0kJ热量,有______gFeO被氧化。
方案II:利用CO2制备CH4
300℃时,向2L恒容密闭容器中充入2mol CO2和8molH2,发生反应CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) △H4,混合气体中CH4的浓度与反应时间的关系如图所示。
CH4(g)+2H2O(g) △H4,混合气体中CH4的浓度与反应时间的关系如图所示。

(3) ①从反应开始到恰好达到平衡时,H2的平均反应速率v(H2)=________。
②300℃时,反应的平衡常数K=________。
③保持温度不变,向平衡后的容器中再充入2molCO2和8molH2,重新达到平衡时CH4的浓度_______(填字母)。
A.等于0.8mol/L B.等于1.6mol/L
C.0.8 mol/L <c(CH4)<1.6 mol/L D.大于1.6 mol/L
(4)300℃时,如果该容器中有1.6molCO2、2.0molH2、5.6molCH4、4.0molH2O(g),则v正____v逆(填“>”“<”或“=”)。
(5)已知:200℃时.该反应的平衡常数K=61.8L2·mol-2。则△H4___0(填“>”“<”或“=”)。
方案Ⅲ:用碱溶液吸收CO2
利用100mL3mol/LNaOH溶液吸收4.48LCO2(标准状况),得到吸收液。
(6)该吸收液中离子浓度的大小排序为____________。将该吸收液蒸干,灼烧至恒重,所得固体的成分是_______(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com