
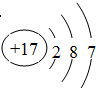 ; 铁在氯气中燃烧,生成FeCl3,氯气中氯元素的化合价降低,是氧化剂;
; 铁在氯气中燃烧,生成FeCl3,氯气中氯元素的化合价降低,是氧化剂;
| ||
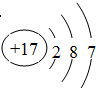 ;FeCl3;氧化;28.
;FeCl3;氧化;28.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
| A、酸性FeSO4溶液中加入双氧水:2Fe2++H2O2+2H+═2Fe3++2H2O | ||||
B、电解饱和MgCl2溶液:2H2O+2Cl-
| ||||
| C、向Ca(ClO)2溶液中通入SO2气体:Ca2++2ClO-+H2O+SO2═CaSO3↓+2HClO | ||||
| D、向饱和碳酸氢钙溶液中加入足量氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有A、E、R、X、Y、Z六种前四周期元素,原子序数依次增大,基态A原子的2p轨道处半充满状态,原子的第一电离能E<A,R是地壳中含量最高的金属元素,X原子核外的M层中有三对成对电子,Y为周期表前四周期中电负性最小的元素,Z原子核外电子数为24.
有A、E、R、X、Y、Z六种前四周期元素,原子序数依次增大,基态A原子的2p轨道处半充满状态,原子的第一电离能E<A,R是地壳中含量最高的金属元素,X原子核外的M层中有三对成对电子,Y为周期表前四周期中电负性最小的元素,Z原子核外电子数为24.查看答案和解析>>
科目:高中化学 来源: 题型:
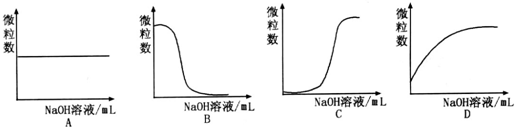
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、既能发生加成反应又能发生取代反应 |
| B、在溶液中该分子的羟基可以电离出H+ |
| C、该分子中含有两种官能团 |
| D、该分子中所有碳原于不可能完全共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、足量Fe在1mol Cl2中充分燃烧,转移3NA个电子 |
| B、7.8g Na2O2中阴、阳离子总数为0.3NA |
| C、电解精炼铜时,若转移NA个电子,则阳极减少的质量为32g |
| D、反应KClO3+6HCl═KCl+3Cl2↑+3H2O中,若有1 mol H2O生成,转移电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试管 | 盐酸浓度 | 温度 | 锌的状态 |
| A | 0.5mol?L-1 | 20℃ | 块状 |
| B | 0.5mol?L-1 | 20℃ | 粉末状 |
| C | 0.5mol?L-1 | 35℃ | 粉末状 |
| D | 18mol?L-1 | 35℃ | 粉末状 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com