
(8分)称取m(g) H2C2O4?2H2O(相对分子质量为126.0)溶于水配成250.00 mL溶液。移取25.00 mL溶液加适量H2SO4后用KMnO4(c mol/L)溶液滴定(MnO4- ® Mn2+,H2C2O4 ® 2CO2),消耗V mL。请写出氧化还原反应方程式和求c(mol/L)的计算式。
某次取样后忘记了加H2SO4,就用KMnO4滴定,开始现象正常,不久出现红褐色沉淀,请解释现象。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
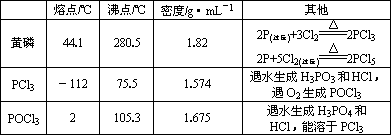
| 熔点/℃ | 沸点/℃ | 密度/g?mL | 其他 | |||||||||
| 黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2
2P+5Cl2(过量)
| ||||||||
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 | ||||||||
| POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于 PCl3 |
| ||
| ||
(c1V1-
| ||
| m |
(c1V1-
| ||
| m |
查看答案和解析>>
科目:高中化学 来源: 题型:
 随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高.现有一种简单可行的测定方法,具体步骤为:
随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高.现有一种简单可行的测定方法,具体步骤为:查看答案和解析>>
科目:高中化学 来源:江苏省无锡市2012届高三上学期期中考试化学试题 题型:058
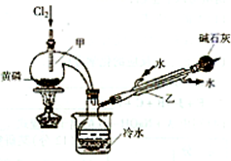
PCl3可用于半导体生产的外延、扩散工序.有关物质的部分性质如下:
(一)制备
下图是实验室制备PCI3的装置(部分仪器已省略)

(1)仪器乙的名称________;
(2)实验室制备Cl2的离子方程式:________;
(3)碱石灰的作用是________,________;
(4)向仪器甲中通人干燥Cl2之前,应先通人一段时间的CO2,其目的是________.
(二)提纯
粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过________(填实验操作名称),即可得到PCl3的纯品.
(三)分析
测定产品中PCl3纯度的方法如下:迅速称取m,g产品,水解完全后配成500 mL溶液,取出25.00 mL加入过量的c1mol·L-l V1mL碘溶液,充分反应后再用c2mol·L-1 Na2S2O3溶液滴定过量的碘,终点时消耗V2mL Na2S2O3溶液.
已知:H3PO3+H2O+I2 H3PO4+2HI;I2+2Na2S2O3
H3PO4+2HI;I2+2Na2S2O3 2NaI+Na2S4O6;假设测定过程中没有其他反应.
2NaI+Na2S4O6;假设测定过程中没有其他反应.
根据上述数据,该产品中PCl3的质量分数为________(用含字母的代数式表示、不必化简)
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)称取m(g) H2C2O4?2H2O(相对分子质量为126.0)溶于水配成250.00 mL溶液。移取25.00 mL溶液加适量H2SO4后用KMnO4(c mol/L)溶液滴定(MnO4- ® Mn2+,H2C2O4 ® 2CO2),消耗V mL。请写出氧化还原反应方程式和求c(mol/L)的计算式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com