



| ||
| CH3OH |
| ||
| H+ |




| 浓H2SO4 |
| △ |


| 浓H2SO4 |
| △ |

 .
. .
.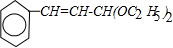 ,A和溴的水溶液发生加成反应生成B
,A和溴的水溶液发生加成反应生成B ,B在强碱的水溶液中发生取代反应生成C
,B在强碱的水溶液中发生取代反应生成C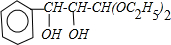 ,C和酸反应生成D
,C和酸反应生成D ,E是含有羟基的酸,所以能发生分子间酯化反应生成酯F..
,E是含有羟基的酸,所以能发生分子间酯化反应生成酯F.. .
. .
.
| 浓H2SO4 |
| △ |
 .
.
| 浓H2SO4 |
| △ |



科目:高中化学 来源: 题型:阅读理解
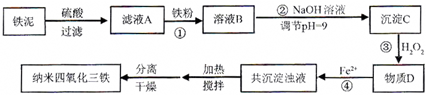
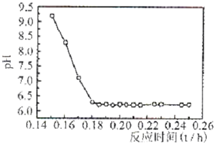
| 实验序号 | 双氧水(mL) | pH | 反应时间 |
| 1 | 0.5 | 11 | 3 |
| 2 | 0.4 | 11 | 3 |
| 3 | 0.6 | 11 | 3 |
| 4 | 0.5 | 10 | 3 |
| 5 | |||
| 6 | |||
| 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2011?厦门一模)常用于除去高速公路冰雪的是“氧盐类”融雪剂,如NaCl、MgCl2等.请回答
(2011?厦门一模)常用于除去高速公路冰雪的是“氧盐类”融雪剂,如NaCl、MgCl2等.请回答| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com