
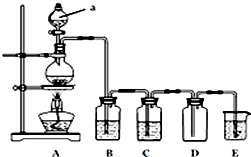
分析 由实验装置可知,a为分液漏斗,制备纯净、干燥的氯气,则分液漏斗中为浓盐酸,烧瓶中为二氧化锰,B中为饱和食盐水除去HCl,C为浓硫酸干燥氯气,D为收集装置,E为尾气处理装置,以此来解答.
解答 解:(1)由图可知,仪器a的名称是分液漏斗,故答案为:分液漏斗;
(2)①圆底烧瓶内发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
②装置C中的溶液为浓硫酸,可干燥气体;B溶液的作用为吸收氯气中的氯化氢,故答案为:浓硫酸;吸收氯气中的氯化氢.
点评 本题考查氯气的制备及性质实验,为高频考点,把握制备原理及实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 有机化合物中只存在极性键 | |
| B. | 碳原子最外层有4个电子,在形成化合物时必须与4个原子结合 | |
| C. | 碳原子间可形成非极性键 | |
| D. | 碳原子易失去或获得电子而形成阳离子或阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ | |
| B. | 气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 | |
| C. | 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+ | |
| D. | 在溶液中加稀盐酸,无现象,继续加入BaCl2溶液产生白色沉淀,证明原溶液有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Y>Z>X | |
| B. | 气态氢化物的稳定性:Z<X | |
| C. | Y、Z的氧化物都有两性 | |
| D. | Y、W最高价氧化物对应水化物间可以相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
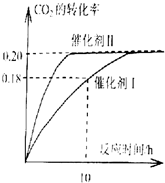 已知CO2可以生产绿色燃料甲醇,反应如下:
已知CO2可以生产绿色燃料甲醇,反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
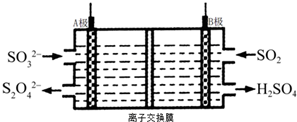
| A. | A电极接电源的正极 | |
| B. | A极区溶液的碱性逐渐增强 | |
| C. | 本装置中使用的是阴离子交换膜 | |
| D. | B极的电极反应式为SO2+2e-+2H2O═SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位物质的量的气体所占的体积就是气体摩尔体积 | |
| B. | 通常状况下的气体摩尔体积约为22.4 L | |
| C. | 标准状况下的气体摩尔体积约为22.4 L | |
| D. | 相同物质的量的气体摩尔体积也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol固体氯化氨中存在离子数小于2NA | |
| B. | 标准状况下,22.4L己烷中共价键的数目为19NA | |
| C. | 标况下的NO2气体22.4L,其中含有的氮原子数为NA | |
| D. | 常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com