
加入盐酸体积V/Ml | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
测得溶液温度t/ ℃ | 15.2 | 19.6 | 22.0 | 26.0 | 28.2 | 26.7 | 25.7 | 24.7 | 23.7 | 22.9 |
(1)试绘出溶液的温度与加入盐酸的体积之间的变化关系曲线。

(2)根据曲线讨论溶液温度变化的原因。
①加入盐酸的量在2—10 mL之间时:_____________________________________________;
②加入盐酸的量在10—20 mL之间时:____________________________________________。
(3)若某同学提出“将氢氧化钠固体直接与10%盐酸反应,以探究中和反应是否放热”,此提议是否合理?为什么?
答:_______________________________________________________________。
科目:高中化学 来源:辽宁省沈阳二中2011届高三第四次阶段测试化学试题 题型:058
甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇.
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1
CO(g)+3H2(g) ΔH1
②CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
将0.20 mol CH4和0.30 mol H2O(g)通入容积为10 L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如下图.

(1)温度不变,缩小体积,①的逆反应速率________(填“增大”、“减小”或“不变”)
(2)反应①的ΔH1________0(填“<”“=”或“>”)100℃时的平衡常数值K=________.
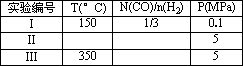
(3)在压强为0.1 Mpa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下进行反应②再生成甲醇.为了发寻找合成甲醇的适宜的温度和压强,某同学设计了二组实验,部分实验条件已经填在下面实验设计表中.请在空格中填入剩余的实验条件数据.
300℃时,其他条件不变,将容器的容积压缩到原来的1/2,对平衡体系产生的影响是________(填字母)
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加
D.重新平衡时c(H2)/c(CH2OH)减小
(4)已知在常温常压下:
①2CH2OH(l)+3O2(g)=2CO2(g)+4H2O(g)ΔH=-1275.6 kJ/mol
②2CO(g)+O2(g)=2CO2(g)ΔH=-556.0 kJ/mol
③H2O(g)=H2O(l)ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳的液态水的热化学方程式________.
(5)某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置.

①该电池正极的电极反应为________.
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
________.
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定体积的10%的氢氧化钠溶液中滴加10%的盐酸,反应中溶液的温度与加入盐酸的体积变化如下:
| 加入盐酸体积V/Ml | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 测得溶液温度t/ ℃ | 15.2 | 19.6 | 22.0 | 26.0 | 28.2 | 26.7 | 25.7 | 24.7 | 23.7 | 22.9 |
(1)试绘出溶液的温度与加入盐酸的体积之间的变化关系曲线。

(2)根据曲线讨论溶液温度变化的原因。
①加入盐酸的量在2—10 mL之间时:_____________________________________________;
②加入盐酸的量在10—20 mL之间时:____________________________________________。
(3)若某同学提出“将氢氧化钠固体直接与10%盐酸反应,以探究中和反应是否放热”,此提议是否合理?为什么?
答:__________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014届福建省高二下学期期中考化学卷(解析版) 题型:填空题
Ⅰ.在一定体积的密闭容器中,进行如下化学反应:其化学平衡常数K与温度t的关系如下:CO2(g)+H2(g)
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
|
t(℃) |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
请回答下列问题:
(1)该反应为 反应(填“吸热”或“放热”)。
(2)800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO) =" 0.01" mol/L,c(H2O) =" 0.03" mol/L,c(CO2) =" 0.01" mol/L,c(H2) =" 0.05" mol/L,则反应开始时,H2O的消耗速率比生成速率 __ _(填“大”、“小”或“不能确定”)。
Ⅱ.超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(NO) (mol/L) |
1.00×10-3 |
4.50×10-4 |
2.50×10-4 |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
|
c(CO) (mol/L) |
3.60×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H 0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)= 。
(3)在该温度下,反应的平衡常数K= 。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
用18 mol·L-1 浓硫酸配制100 mL 3.0 mol·L-1 稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解
④转移 ⑤洗涤 ⑥定容 ⑦摇匀
完成下列问题:
(1)所需浓硫酸的体积是________,量取浓硫酸所用的量筒的规格是________(从下列中选用A.10 mL B.25 mL C.50 mL D.100 mL)。
(2)第③步实验的操作是________________________________。
(3)第⑥步实验的操作是________________________________。
(4)下列情况对所配制的稀硫酸浓度偏小有_________
A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏洗涤后残留有少量的水
C.所用过的烧杯、玻璃棒未洗涤
D.定容时俯视刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com