
| A、某弱酸的酸式盐NaHA溶液中一定有:c(OH-)+2c(A2-)=c(H+)+c(H2A) |
| B、1mol?L-1CH3COONa溶液与0.5mol?L-1盐酸等体积混合后的酸性溶液中:c(CH3COO-)>c(CH3COOH)>c(Cl-)>c(H+) |
| C、0.1mol?L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3?H2O)+c(Fe2+)=0.3mol?L-1 |
| D、物质的量浓度相等的HCN溶液和NaCN溶液等体积混合后的溶液中:c(CN-)+2c(OH-)=2c(H+)+c(NCN) |


科目:高中化学 来源:2014-2015学年山东省高三上学期12月月考化学试卷(解析版) 题型:选择题
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示

下列判断正确的是
A.a、c两点溶液的导电能力相同
B.b点溶液中c(H+)+c(NH3·H2O)===c(OH-)
C.a、b、c三点溶液中水的电离程度a>b>c
D.用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb=Vc
查看答案和解析>>
科目:高中化学 来源: 题型:
| 顺序 | 步骤 | 实验现象 |
| ① | 取少量纯净的NaCl,加适量蒸馏水溶解 | 溶液无变化 |
| ② | 滴入少量淀粉-KI溶液,振荡 | 溶液无变化 |
| ③ | 然后再滴加稀硫酸,振荡 | 溶液变蓝色 |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量食盐样品于试管中,加适量蒸馏水使其完全溶解, | |
| 步骤2:另取少量食盐样品于试管中,加适量蒸馏水使其完全溶解,滴入适量的稀硫酸酸化, |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、X可能含有2种盐 |
| B、Y可能含有(NH4)2SO4 |
| C、a是SO3 |
| D、(NH4)2S2O8中S的化合价不可能为+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质 | 沸点(℃) |
| 乙醇 | 78.5 |
| 乙酸 | 117.9 |
| 乙酸乙酯 | 77 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系如图所示,则下列说法中正确的是( )
第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系如图所示,则下列说法中正确的是( )| A、Z的氧化物可与Y的氢化物水溶液发生化学反应 |
| B、X的原子半径比As原子半径小,两者原子序数之差为29 |
| C、W的氧化物对应的水化物是共价化合物,并且必是强酸 |
| D、图中五种元素均是非金属元素,并且Y的非金属性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、R元素最高价氧化物所对应的水化物具有两性,但不会溶于稀氨水 |
| B、Y分别可与X和Z形成原子个数比为1:1的化合物,且形成的化合物晶体类型相同 |
| C、Y的氢化物分子间存在氢键,因此Y的氢化物的稳定性大于W的氢化物的稳定性 |
| D、原子半径从小到大:X<Y<Z<R<W |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Ca(OH)2溶液中加入过量的NaHCO3溶液Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O |
| B、向100 mL 0.12 mol/L-1的Ba(OH)2溶液中通入0.02 mol CO2:Ba2++3OH+2CO2=HCO3+BaCO3↓+H2O |
| C、硫酸氢钠与氢氧化钡两种溶液反应后pH恰好为7:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| D、向含0.1molNaOH和0.1molNa2CO3的溶液中加入1L 0.4mol?L-1稀盐酸OH-+CO32-+3H+=CO2↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
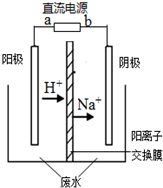 最近有研究人员利用隔膜电解法处理高浓度的乙醛废水.乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法不正确的是( )
最近有研究人员利用隔膜电解法处理高浓度的乙醛废水.乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法不正确的是( )| A、电解过程中,阴极附近的乙醛被氧化 |
| B、阳极反应CH3CHO-2e-+H2O═CH3COOH+2H+ |
| C、若以CH4-空气燃料电池为直流电源,燃料电池的b极应通入CH4 |
| D、现处理含1mol乙醛的废水,至少需转移1mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com