
【题目】A是化合物,B是金属单质,它们之间相互反应以及生成物之间的转化关系如图所示: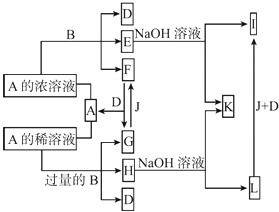
(1)金属B在元素周期表中的位置是 , B和A的浓溶液反应的条件是 . 写出少量B与A的稀溶液反应的离子方程式: .
(2)常温下0.1 mol/L E的水溶液中各离子浓度大小关系为 .
(3)L转化为I的现象是 . 写出有关的化学方程式: .
(4)如何检测H溶液中阳离子的存在,写出实验操作方法、现象、结论: .
(5)已知25℃时Fe(OH)3的Ksp=3.5×10﹣39 , 现将4.0×10﹣8 mol/L E溶液与2.0×10﹣8 mol/L NaOH溶液等体积混合(忽略溶液混合时体积的变化),通过列式计算说明是否有沉淀产生: .
【答案】
(1)第四周期Ⅷ族;加热;Fe+4H++NO ![]() =Fe2++NO↑+2H2O
=Fe2++NO↑+2H2O
(2)c(NO ![]() )>c(Fe3+)>c(OH﹣)>c(H+)
)>c(Fe3+)>c(OH﹣)>c(H+)
(3)白色沉淀变成灰绿色,最终变成红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3
(4)取少量H溶液于试管中,先加入几滴KSN溶液,无明显现象,再加几滴新制的氯水,溶液变为血红色,证明溶液中含有Fe2+
(5)混合后溶液中的c(Fe3+)=2×10﹣8mol/L,c(OH﹣)=1×10﹣8mol/L,则Qc=c(Fe3+)×c3(OH﹣)=2.0×10﹣32>Ksp , 有沉淀生成
【解析】解:E、H与氢氧化钠溶液反应分别生成I、L,I和L又能和J、D发生转化,说明金属B为变价金属,B可能为Fe.E、H均为B盐溶液,A能与B反应生成多种物质,说明A为酸,A与Fe反应时与酸的浓度有关,则A可能是硫酸或硝酸,根据G+J→F可以判断A是硝酸不是硫酸(氢气与二氧化硫无法转化),故酸A为HNO3 , B为Fe,结合转化关系,可推知F为NO2 , A为HNO3 , E为Fe(NO3)3、D为H2O、I为Fe(OH)3、G为NO、F为O2、H为Fe(NO3)2 , L为Fe(OH)2 , K为NaNO3 . (1)金属B为Fe,在元素周期表中的位置是:第四周期Ⅷ族,Fe和浓硝酸反应的条件是:加热,少量Fe与稀硝酸反应的离子方程式:Fe+4H++NO3﹣=Fe2++NO↑+2H2O,故答案为:第四周期Ⅷ族;加热;Fe+4H++NO3﹣=Fe2++NO↑+2H2O;(2)常温下0.1 mol/L Fe(NO3)3的水溶液中Fe3+水解,溶液呈酸性,各离子浓度大小关系为:,故答案为:c(NO3﹣)>c(Fe3+)>c(OH﹣)>c(H+),故答案为:c(NO3﹣)>c(Fe3+)>c(OH﹣)>c(H+);(3)L转化成I的现象是:白色沉淀变成灰绿色,最终变成红褐色,有关的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3 , 故答案为:白色沉淀变成灰绿色,最终变成红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3;(4)检测Fe(NO3)2溶液中阳离子的存在:取少量H溶液于试管中,先加入几滴KSN溶液,无明显现象,再加几滴新制的氯水,溶液变为血红色,证明溶液中含有Fe2+ , 故答案为:取少量H溶液于试管中,先加入几滴KSN溶液,无明显现象,再加几滴新制的氯水,溶液变为血红色,证明溶液中含有Fe2+;(5)等体积混合的瞬间,体积加倍浓度减半,混合后溶液中的c(Fe3+)=2×10﹣8mol/L,c(OH﹣)=1×10﹣8mol/L,则Qc=c(Fe3+)×c3(OH﹣)=2.0×10﹣32>Ksp , 有沉淀生成,故答案为:混合后溶液中的c(Fe3+)=2×10﹣8mol/L,c(OH﹣)=1×10﹣8mol/L,则Qc=c(Fe3+)×c3(OH﹣)=2.0×10﹣32>Ksp , 有沉淀生成.E、H与氢氧化钠溶液反应分别生成I、L,I和L又能和J、D发生转化,说明金属B为变价金属,B可能为Fe.E、H均为B盐溶液,A能与B反应生成多种物质,说明A为酸,A与Fe反应时与酸的浓度有关,则A可能是硫酸或硝酸,根据G+J→F可以判断A是硝酸不是硫酸(氢气与二氧化硫无法转化),故酸A为HNO3 , B为Fe,结合转化关系,可推知F为NO2 , A为HNO3 , E为Fe(NO3)3、D为H2O、I为Fe(OH)3、G为NO、F为O2、H为Fe(NO3)2 , L为Fe(OH)2 , K为NaNO3 , 据此解答.


科目:高中化学 来源: 题型:
【题目】下列实验基本操作(或实验注意事项)中,主要是从实验安全角度考虑的是
A. 实验剩余的药品一般不能放回原试剂瓶
B. 溶解时用玻璃棒搅拌
C. 可燃性气体点燃前必须验纯
D. 过滤时玻璃棒靠在三层滤纸处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质方法正确的是( )
A. 除去CO2中混有的CO:用浓NaOH溶液洗气
B. 除去BaCO3固体中混有的BaSO4:加过量稀盐酸后,过滤、洗涤
C. 除去KNO3溶液中混有的NaCl:蒸发结晶
D. 除去Cu粉中混有的CuO:加适量稀硫酸后,过滤、洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定某盐酸的物质的量浓度.
(1)标准溶液应盛于(填“A”或“B”)滴定管中. 
(2)若选用酚酞作指示剂,以0.125 0molL﹣1的标准氢氧化钠溶液滴定,如何判断滴定终点
(3)实验数据记录如表,请分析数据并计算,盐酸的物质的量浓度=molL﹣1
滴定次数 | 待测液体体积/mL | 标准碱液 | |
滴定前读数/mL | 滴定后读数/mL | ||
① | 20.0 | 0.40 | 20.41 |
② | 20.0 | 0.10 | 20.60 |
③ | 20.0 | 4.00 | 23.99 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级四氧化三铁是应用最为广泛的软磁性材料之一。共沉淀法是目前制备纳米四氧化三铁的重要方法,其流程如图示:

下列说法不正确的是
A.保存溶液A时,应加入少量铁粉
B.其制备反应类型不属于氧化还原反应
C.取滤液进行焰色反应,火焰为黄色
D.FeSO4·7H2O 和 FeCl3·6H2O的物质的量之比最好应为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质均为常见物质或它们的溶液,其中 A为淡黄色固体, C、X 均为无色气体,Z为浅绿色溶液,D为一种常见的强碱。根据它们之间的转化关系(下图),回答下列问题: (部分反应物与产物已省略)

(1)写出下列物质的化学式: A______B________ D________
(2)A 与 SO3(g)的反应类似于 A 与 X 的反应,请写出 A 与 SO3(g)反应的化学方程式并标出该反应电子转移的方向和数目:___________________。
(3)向Z 溶液中通入足量的Cl2,写出检验Z 中阳离子所需试剂___________。
(4)向含 10g D 的溶液中通入一定量的 X,完全反应后,在低温条件下蒸发结晶,最终得到 14.8g 固体。
①简述蒸发结晶在低温条件下进行的理由:______________(用必要的文字回答)
②所得固体中含有的物质及其它们的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】描述CH3﹣CH=CH﹣C≡C﹣CF3分子结构下列叙述中,正确的是( )
A.6个碳原子有可能都在一条直线上
B.6个碳原子不可能都在一条直线上
C.6个碳原子不可能都在一个平面上
D.所有原子可能都在一个平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:

(1)分别用离子方程式表示图中OA段、AB段的反应原理_________________________、_____________________________.
(2)最大沉淀质量为_____g
(3)所用AlCl3溶液的物质的量浓度是______________
(4)当所得沉淀量为0.39g时,用去NaOH溶液的体积是_____mL或_____mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com