
【题目】现有①BaCl2②金刚石 ③KOH ④H2SO4⑤干冰 ⑥碘片 ⑦晶体硅 ⑧金属铜 八种物质,按下列要求回答:(填序号)
(1)熔化时不需要破坏化学键的是________,熔化时需要破坏共价键的是________,熔点最高的是________,熔点最低的是________。
(2)属于离子化合物的是________,只有离子键的物质是________,晶体以分子间作用力结合的是________。
(3)请写出③的电子式______,⑤的电子式______。
【答案】④⑤⑥ ②⑦ ② ⑤ ①③ ① ④⑤⑥ ![]()
![]()
【解析】
①BaCl2是离子晶体,只含有离子键,熔化时破坏离子键;
②金刚石是原子晶体,只含有共价键,熔化时破坏共价键;
④H2SO4是分子晶体,熔化时破坏分子间作用力,不破坏共价键;
⑤干冰是分子晶体,熔化时破坏分子间作用力,不破坏共价键;
⑥碘片是分子晶体,熔化时破坏分子间作用力,不破坏共价键;
⑦晶体硅是原子晶体,只含有共价键,熔化时破坏共价键;
⑧金属铜是金色晶体,只含有金属键,熔化时破坏金属键。
(1)分子晶体在熔化时不需要破坏化学键,H2SO4、干冰、碘片属于分子晶体的,熔化时破坏分子间作用力,不破坏共价键;原子晶体在熔化时破坏共价键,金刚石、晶体硅属于原子晶体,熔化时破坏共价键;原子晶体的熔点高,金刚石与硅相比,C的原子半径小于Si原子半径,属于金刚石的共价键更强,熔点更高,则熔点最高的是金刚石;常温下是气体的物质的熔点最低,则干冰的熔点最低,故答案为:④⑤⑥;②⑦;②;⑤;
(2)BaCl2、KOH中含有离子键,属于离子化合物,其中BaCl2中只有离子键;以分子间作用力相结合的晶体是分子晶体,则④⑤⑥是分子晶体,故答案为:①③;①;④⑤⑥;
(3)KOH是离子化合物,是由钾离子和氢氧根离子形成,电子式为![]() ;干冰是二氧化碳,二氧化碳是含有碳氧双键的共价化合物,电子式为
;干冰是二氧化碳,二氧化碳是含有碳氧双键的共价化合物,电子式为![]() ,故答案为:
,故答案为:![]() ;
;![]() 。
。


科目:高中化学 来源: 题型:
【题目】用废铁屑制备磁性胶体粒子,制取过程如下:

下列说法不正确的是
A. 用Na2CO3溶液浸泡是为了除去废铁屑表面的油污
B. 通入N2是防止空气中的O2氧化二价铁元素
C. 加适量的H2O2是为了将部分Fe2+氧化为Fe3+,涉及反应:H2O2+2Fe2++2H+=2Fe3++2 H2O
D. 溶液A中Fe2+和Fe3+的浓度比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种饲料营养强化剂。可由水钴矿[主要成分为
是一种饲料营养强化剂。可由水钴矿[主要成分为![]() ,还含有少量
,还含有少量![]() 等]制取,其工艺流程如下:
等]制取,其工艺流程如下:
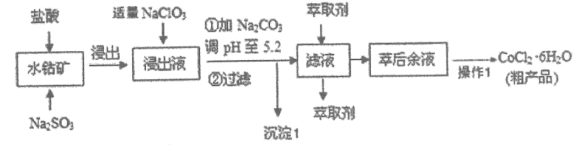
已知:a.浸出液中含有的阳离子主要有![]() 等。
等。
b.流程中部分阳离子以氢氧化物形式沉淀时溶液的![]() 见下表。
见下表。
沉淀物 |
|
|
|
|
|
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
回答下列问题:
(1)浸出水钴矿过程中,![]() 发生反应的离子方程式为_____________________。
发生反应的离子方程式为_____________________。
(2)向浸出液中加入适量![]() 的目的是_______________________。
的目的是_______________________。
(3)工艺流程中沉淀1的主要成分为________________(填化学式)。
(4)萃取剂对金属离子的萃取率与溶液![]() 的关系如图所示,向“滤液”中加入该萃取剂的目的是__________,使用该萃取剂的最佳
的关系如图所示,向“滤液”中加入该萃取剂的目的是__________,使用该萃取剂的最佳![]() 范围是_______(填选项字母)。
范围是_______(填选项字母)。
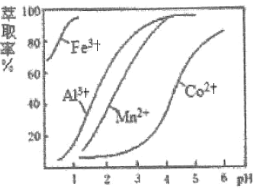
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(5)工艺流程中“操作1”为__________、_________、过滤和用无水乙醇洗涤后干燥;用无水乙醇洗涤的目的是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物的化学式为[Cr(CH3COO)2]2·2H2O,该水合物通常为红棕色晶体,是一种常用的氧气吸收剂,不溶于水和乙醚(一种易挥发的有机溶剂),微溶于乙醇,易溶于盐酸,易被氧化。已知Cr3+水溶液呈绿色,Cr2+水溶液呈蓝色。实验室制备醋酸亚铬水合物的装置如下图所示。

(1)检查装置气密性后,向左侧三颈烧瓶中依次加入过量锌粒和适量CrCl3溶液,关闭K1打开K2,旋开a的旋塞,控制好滴速。a的名称是___________,此时左侧三颈烧瓶中发生反应的化学方程式为_______、________。一段时间后,整个装置内充满氢气,将空气排出。当观察到左侧三颈烧瓶中溶液颜色由绿色完全转变为蓝色时,关闭K2,打开K1,将左侧三颈烧瓶内生成的CrCl2溶液压入右侧三颈烧瓶中,则右侧三颈烧瓶中发生反应的离子方程式为________________________________________。
(2)本实验中所有配制溶液的水均需煮沸,其原因是______________________。右侧的烧怀内盛有水,其中水的作用是_______________________________________________。
(3)当观察到右侧三颈烧瓶内出现大量红棕色晶体时,关闭a 的旋塞。将红棕色晶体快速过滤、水洗、乙醚洗、干燥,即得到[Cr(CH3COO)2]2·2H2O。其中用乙醚洗涤产物的目的是_______________________。
(4)称量得到的[Cr(CH3COO)2]2·2H2O晶体,质量为m g,,若所取用的CrCl3溶液中含溶质n g,则[Cr(CH3COO)2]2·2H2O(M1=376 )的产率是______%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用镁还原硝基苯制取反式偶氮苯。实验原理如下:
2![]() +4Mg+8CH3OH→
+4Mg+8CH3OH→![]() +4Mg(OCH3)2+4H2O
+4Mg(OCH3)2+4H2O
已知:①Mg(OCH3)2在水中极易水解。
②反式偶氮苯产品在紫外线照射后部分转化为顺式偶氮苯。
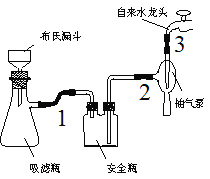
⑴在反应装置中,加入原料及溶剂,搅拌下加热回流。反应加入的镁条应用砂纸打磨干净的的原因是___________。
⑵反应结束后将反应液倒入冰水中,用乙酸中和至中性,即有反式偶氮苯粗产品析出,抽滤,滤渣用95%乙醇水溶液重结晶提纯。
①为了得到较大颗粒的晶体,加入乙酸时需要___________(填“缓慢加入”、“快速加入”)。
②烧杯中的反式偶氮苯转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上的晶体冲洗下来后转入布氏漏斗,下列液体最合适的是___________。
A.冰水 B.饱和NaCl溶液
C.95%乙醇水溶液 D.滤液
③抽滤完毕,应先断开___________之间的橡皮管,以防倒吸。
④重结晶操作包括“加热溶解、趁热过滤、冷却结晶、抽滤、洗涤、干燥”。上述重结晶过程中的___________操作除去了不溶性杂质。
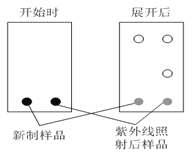
⑶薄层色谱分析中,极性弱的物质,在溶剂中扩散更快。某同学采用薄层色谱分析所得偶氮苯,实验开始时和展开后的斑点如图所示,则反式偶氮苯比顺式偶氮苯的分子极性___________(填“强”或“弱”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工发展水平。请回答下列问题:
(1)乙烯的结构简式为________。
(2)鉴别甲烷和乙烯的试剂是________(填字母)。
A.稀硫酸 B.溴的四氯化碳溶液 C.水 D.酸性高锰酸钾溶液
(3)下列物质中,可以通过乙烯加成反应得到的是________(填字母)。
A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
(4)若以乙烯为主要原料合成乙酸,其合成路线如图所示。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
则反应③的反应类型为________,反应②的化学方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表诞生150周年,元素周期表在学习、研究和生产实践中有很重要的作用。①~⑥六种元素在元素周期表中的位置如下:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ |
请回答下列问题:
(1)⑥的元素符号为___________。
(2)由①③④形成的化合物是一种强碱,其化学式____________。
(3)由①②形成的最简单化合物的分子模型为_____________(填序号)
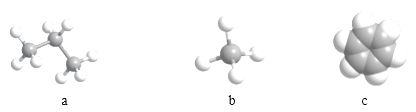
(4)⑤和⑥两种元素的最高价氧化物对应的水化物之间反应的离子方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯的原子序数为17,35Cl是氯元素的一种核素,下列说法正确的是
A.35Cl原子所含质子数为18B.![]() mol的1H35Cl分子所含中子数约为6.02×1023
mol的1H35Cl分子所含中子数约为6.02×1023
C.3.5 g的35Cl2气体的体积为2.24 LD.35Cl2气体的摩尔质量为71 g / mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com