
 WI2(g) (I)。该反应在石英真空管中进行,如下图所示:
WI2(g) (I)。该反应在石英真空管中进行,如下图所示: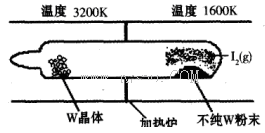
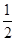 ,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。
,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。 HSO3-+H+的电离常数Ka=____mol/L,若向H2SO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=____mol/L,若向H2SO3溶液中加入少量的I2,则溶液中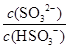 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。| n(SO32-): n ( HSO3-) | 91:9 | 1:1 | 1:91 |
| pH(25℃) | 8.2 | 7.2 | 6.2 |
 (2分,化学式写错不得分,漏写“c( )”其他正确只得1分) 33.3% 或33%(2分,合理答案即可)② <(2分,写“小于”不得分) I2(或碘)(2分,写“化学式”或“名称”均得分)③bc (b 1分,c 1分,b、c2分,其他情况不得分,大写字母不得分)
(2分,化学式写错不得分,漏写“c( )”其他正确只得1分) 33.3% 或33%(2分,合理答案即可)② <(2分,写“小于”不得分) I2(或碘)(2分,写“化学式”或“名称”均得分)③bc (b 1分,c 1分,b、c2分,其他情况不得分,大写字母不得分) WI2(g)可知,该反应的平衡常数表达式K=
WI2(g)可知,该反应的平衡常数表达式K= ,根据方程式可知
,根据方程式可知 WI2(g)
WI2(g) =
= =
=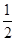

 ×100%=33.3%。
×100%=33.3%。 H2SO3+OH-,则水解平衡常数表达式=
H2SO3+OH-,则水解平衡常数表达式=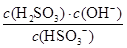 ,则
,则 =
= =1.0×10
=1.0×10 mol/L,所以该温度下H2SO3
mol/L,所以该温度下H2SO3 HSO3-+H+的电离常数Ka=
HSO3-+H+的电离常数Ka= =1.0×10-2mol/L;若向H2SO3溶液中加入少量的I2,由于单质碘能把亚硫酸氧化生成硫酸,所以使亚硫酸的电离平衡向逆反应方向移动,因此溶液中
=1.0×10-2mol/L;若向H2SO3溶液中加入少量的I2,由于单质碘能把亚硫酸氧化生成硫酸,所以使亚硫酸的电离平衡向逆反应方向移动,因此溶液中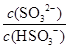 将减小。
将减小。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
 B(g)+3C(g),下列四项中处于平衡状态的是( )
B(g)+3C(g),下列四项中处于平衡状态的是( )| | 正反应速率 | 逆反应速率 |
| A | v(A)=2mol/(L·min) | v(B)=2mol/(L·min) |
| B | v(A)=2mol/(L·min) | v(C)=2mol/(L·min) |
| C | v(A)=1mol/(L·min) | v(B)=2mol/(L·min) |
| D | v(A)=1mol/(L·min) | v(C)=1.5mol/(L·min) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 FeO(s)+CO(g) ΔH>0。
FeO(s)+CO(g) ΔH>0。 CO(g)+H2(g),试分析和回答下列问题:
CO(g)+H2(g),试分析和回答下列问题:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 化学方程式 | 平衡常数K |
F2+H2 2HF 2HF | 6.5×1095 |
Cl2+H2 2HCl 2HCl | 2.6×1033 |
Br2+H2 2HBr 2HBr | 1.9×1019 |
I2+H2 2HI 2HI | 8.7×102 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Ni(CO)4(g)+Q
Ni(CO)4(g)+Q Ni(s)+4CO(g)
Ni(s)+4CO(g)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g),若开始时只充入2 molSO3,达到平衡时,混合气体的压强比起始时增大了10%;若开始时只充入了2 mol SO2和1 molO2的混合气体,达到平衡时SO2的转化率为:
2SO3(g),若开始时只充入2 molSO3,达到平衡时,混合气体的压强比起始时增大了10%;若开始时只充入了2 mol SO2和1 molO2的混合气体,达到平衡时SO2的转化率为:| A.10% | B.60% | C.80% | D.90% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高  PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0 molPCl3 和0.50 molCl2,在相同温度下再达平衡时PCl5的物质的量应大于0.20mol而小于0.40mol
PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0 molPCl3 和0.50 molCl2,在相同温度下再达平衡时PCl5的物质的量应大于0.20mol而小于0.40mol| A.①④ | B.①②③ | C.②③④ | D.①②③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
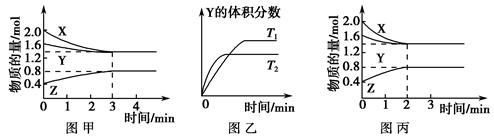
A.该反应可表示为3X(g)+Y(g) 2Z(g) 2Z(g) |
| B.若其他条件不变,升高温度,平衡将向逆反应方向移动 |
| C.若其他条件不变,开始时将该容器压缩为1 L,则反应将按图丙进行 |
| D.若其他条件不变,使用适当的催化剂,则反应可以按图丙进行 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.使用催化剂有利于加快合成氨反应的反应速率 |
| B.硫酸工业中,将黄铁矿粉碎后加入沸腾炉中 |
| C.500℃左右比在室温时更有利于提高合成氨的转化率 |
| D.配制氯化铁溶液时,将氯化铁加入盐酸中,然后加水稀释 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com