
【题目】伏打电堆由几组锌和银的圆板堆积而成,所有的圆板之间夹放着几张盐水泡过的布。如图所示为最初的伏打电堆模型,由八组锌和银串联组成的圆板堆积而成。下列说法正确的是
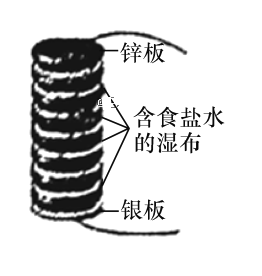
A.该电池发生的反应为析氢腐蚀
B.电池长时间工作后,中间的布上会有白色固体颗粒生成,该固体颗粒为Ag2O
C.当电路中转移0.1 mol电子时,消耗锌板的总质量为26 g
D.该伏打电堆工作时,在银板附近会有Cl2放出
【答案】C
【解析】
根据题中伏打电堆模型可知,本题考查原电池和电解池的工作原理,运用原电池和电解池的工作原理分析。
A.电解质溶液是食盐水,不是酸性环境,则该电池发生的反应为吸氧腐蚀,A项错误;
B.根据电池总反应2Zn+O2+2H2O=2Zn(OH)2可知电池长时间工作后,中间的布上出现白色固体颗粒应是Zn(OH)2,B项错误;
C.负极反应为Zn2e=Zn2+,转移电子0.1mol时,一组锌消耗的质量为0.05mol×65g/mol=3.25g,八组锌消耗的总质量为3.25g×8=26g,C项正确;
D.银作正极,正极上氧气得电子发生还原反应,不会有氯气放出,D项错误;
答案选C。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】用如图所示装置检验乙烯时不需要除杂的是( )
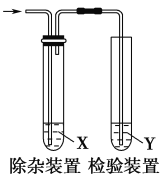
选项 | 乙烯的制备 | 试剂X | 试剂Y |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | 溴水 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( )
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中2Na+Cu2+=Cu+2Na+ |
B | 向Ca(ClO)2溶液中通入少量CO2 Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2 Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
C | 用惰性电极电解NaCl溶液 2Cl-+2H2O | 用惰性电极电解MgBr2溶液 2Br-+2H2O |
D | 稀盐酸与NaOH溶液反应至中性 H++OH-=H2O | 稀HNO3与Ba(OH)2溶液反应至中性 H++OH-=H2O |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1 mol时,下列说法不正确的是
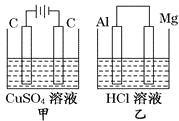
A. 溶液的质量变化:甲减小,乙增大
B. 溶液pH变化:甲减小,乙增大
C. 相同条件下产生气体的体积:V甲=V乙
D. 电极反应式:甲中阴极:Cu2++2e-==Cu,乙中负极:Mg-2e-==Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZnO在医药、石化等领域有广泛的用途。研究小组用某闪锌矿(主要成分ZnS,含有FeS、SiO2、MnCO3等杂质)制备氧化锌和硫单质,设计如下流程:

请回答下列问题:
(1)滤渣1的化学式为_______,任写一种该物质的用途:_______________。
(2)沉淀X的化学式为______________。
(3)“转化Ⅱ”中主要反应的离子方程式为___________________________。
(4)若Ksp(ZnCO3)=1.5×10﹣10,溶液中离子浓度≤1.0×10﹣5molL﹣1时,认为该离子沉淀完全。则欲使1Lc(Zn2+)=1.5molL﹣1溶液中Zn2+沉淀完全,需加入等体积的Na2CO3溶液的物质的量浓度至少为_______________________molL﹣1 (写出精确计算结果,溶液混合时体积变化忽略不计)。
(5)“一系列操作”包括过滤、洗涤、干燥。过滤所用的玻璃仪器有______;洗涤沉淀的操作为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钾和亚硫酸氢钾溶液能发生氧化还原反应ClO3—+3HSO3—=3SO42—+Cl-+3H+。已知该反应的反应速率随c(H+)的增大而增大。如图所示为用ClO3—在单位时间内物质的量浓度变化表示的该反应的υ-t图。下列说法不正确的是( )

A.反应开始时速率增大可能是c(H+)增大所致
B.纵坐标为υ(Cl-)的υ-t曲线与图中曲线完全重合
C.图中阴影部分的面积表示t1~t2时间内ClO3—的物质的量的减少量
D.后期反应速率下降的主要原因是反应物浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的工业原料.煤化工可以利用煤炭制取水煤气从而合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)。常温常压下反应的能量变化如图1所示:
CH3OH(g)。常温常压下反应的能量变化如图1所示:
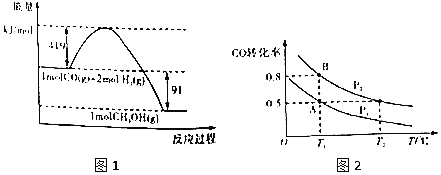
②
化学键 | H—H | H—O | O=O |
键能kJ/mol | 436 | x | 496 |
③CO(g)+ ![]() O2(g)=CO2(g) △H=-280kJ/mol
O2(g)=CO2(g) △H=-280kJ/mol
H2(g)+![]() O2(g)=H2O(l) △H=-284kJ/mol
O2(g)=H2O(l) △H=-284kJ/mol
H2O(l)=H2O(g) △H=+44kJ/mol
请回答下列问题:
(1)甲醇气体分解为CO和H2两种气体这一反应的活化能为__kJ/mol;
(2)请写出表示气态甲醇燃烧热的热化学方程式__;
(3)H—O的键能x值为__;
(4)如图2:在一容积可变的密闭容器中充入10molCO气体和30molH2气体,当达到平衡状态A时,容器的体积为20L。如反应开始时仍充入10molCO和30molH2,则在平衡状态B时容器的体积V(B)=___L;
(5)在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生该反应(起始温度和起始体积相同,反应物和生成物反应前后均为气态).相关数据如表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1molCO、2molH2 | 1molCH3OH | 1molCH3OH |
平衡时容器体积 | V(甲) | V(乙) | V(丙) |
反应的平衡常数K | K(甲) | K(乙) | K(丙) |
平衡时CH3OH的浓度/molL-1 | C(甲) | C(乙) | C(丙) |
平衡时CH3OH的反应速率/molL-1min-1 | v(甲) | v(乙) | v(丙) |
则下列说法正确的是___。
A.V(甲)>V(丙)
B.K(乙)>K(丙)
C.c(乙)>c(甲)
D.v(甲)=v(丙)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是

A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 实验中装置b中的液体逐渐变为浅红色
C. 装置c中的碳酸钠溶液的作用是吸收溴化氢
D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com