
| A. | 为防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 | |
| B. | 药皂中加入少量苯酚,可以起到杀菌消毒的作用 | |
| C. | 石油是混合物,其分馏产品汽油为纯净物 | |
| D. | 金属铝需经过特别处理才具有抗腐蚀能力 |
分析 A.生石灰不具有还原性;
B.苯酚可以使蛋白质变性;
C.石油是混合物,其分馏产品汽油仍然为混合物;
D.常温下,铝在空气中与氧气反应,其表面生成的氧化铝薄膜具有抗腐蚀能力.
解答 解:A.生石灰具有吸水性,可防止食品变潮,不具有还原性,故A错误;
B.药皂中加入少量苯酚可以使病毒细菌中的蛋白质变性,能杀菌消毒,故B正确;
C.石油是烃的混合物,其分馏产品汽油也是烃的混合物,不属于纯净物,故C错误;
D.常温下,铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,具有抗腐蚀能力,从而防止铝进一步氧化,故D错误.
故选B.
点评 本题考查化学与科学、技术、社会、环境等问题,题目难度不大,侧重对基础知识的巩固,注意对基础知识的理解掌握.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯气通入水中:C12+H2O?H++C1-+HClO | |
| B. | 向Mg(HCO3)2溶液中加入过量的澄清石灰水:Mg2++2HCO3-+2OH一+Ca2+═MgCO3+CaCO3↓+2H2O | |
| C. | 将适量的CO2通入Ca(C1O)2溶液中:Ca2++2C1O-+CO2+H2O═2HC1O+CaCO3↓ | |
| D. | Ba(OH)2溶液中加入过量的Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化钠可用作漂白剂 | B. | 明矾可用作净水剂 | ||
| C. | 碳酸氢钠可用于治疗胃酸过多 | D. | 氧化铝可用来制造耐火坩埚 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
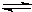 Fe(OH)3(胶体)+3H+.
Fe(OH)3(胶体)+3H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫具有还原性,可用二氧化硫水溶液吸收溴蒸气 | |
| B. | 氢氟酸具有强酸性,可用氢氟酸蚀刻玻璃 | |
| C. | 氨气具有氧化性,可用浓氨水检验氯气管道是否泄漏 | |
| D. | SiO2的导电能力强,可用于制造通讯光缆 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 7.8 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

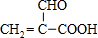
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
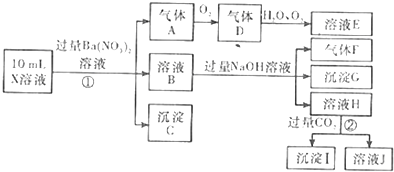
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 工业上制取漂白粉:向澄清石灰水中通入足量的Cl2 | |
| B. | 验证醋酸是弱电解质:常温下测定0.1 mol•L-1醋酸钠溶液的pH | |
| C. | 探究FeCl3和KI溶液反应限度:向5mL0.1 mol•L-1 FeCl3溶液中加入0.1 mol•L-1KI溶液1mL,振荡,加苯萃取后,向水层中加入5滴KSCN溶液,观察实验现象 | |
| D. | 检验蔗糖水解生成的葡萄糖:蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察实验现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com